
| A、海水中含有溴元素,需经过化学变化才可以得到溴单质 | ||||||||
| B、无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 | ||||||||
| C、从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 | ||||||||
D、从海水中提取镁可以采用下列方法:海水海水
|


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、0.4molH2O |
| B、0.2molH2SO4 |
| C、0.4molHCl |
| D、0.3molHNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
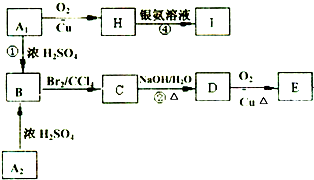 同分异构体A1和A2分别与浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的52倍,含碳的质量分数为92.3%.在催化剂存在下,1mol B可以和4mol H2发生加成反应.核磁共振氢谱显示,H有5个吸收峰.有关物质之间的转化关系如下:
同分异构体A1和A2分别与浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的52倍,含碳的质量分数为92.3%.在催化剂存在下,1mol B可以和4mol H2发生加成反应.核磁共振氢谱显示,H有5个吸收峰.有关物质之间的转化关系如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、26g | B、36g |
| C、104g | D、130g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(OH-)>c(HF)>c(HCN)>c(H+) |
| B、c(OH-)>c(CN-)>c(F-)>c(H+) |
| C、c(OH-)>c(F-)>c(CN-)>c(H+) |
| D、c(F-)>c(OH-)>c(HCN)>c(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
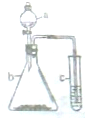 利用如图装置进行实验,仪器a、b、c中分别盛装下列试剂,试管c中现象描述正确的是( )
利用如图装置进行实验,仪器a、b、c中分别盛装下列试剂,试管c中现象描述正确的是( )| 选项 | a | b | c | c试管中现象 |
| A | 浓硫酸 | Na2SO3 | BaCl2溶液 | 产生白色沉淀 |
| B | 稀盐酸 | 大理石 | 苯酚钠溶液 | 产生白色沉淀 |
| C | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液褪色 |
| D | 浓硝酸 | 铜片 | KI淀粉溶液 | 溶液变蓝 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
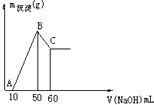
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com