
| A. | 有气泡产生,该气体能使带火星的火柴梗复燃 | |
| B. | 反应后溶液中有晶体析出 | |
| C. | 反应前后溶液中钠离子的浓度不变 | |
| D. | 反应前后溶液中钠离子的质量不变 |
分析 A.过氧化钠和水反应生成氢氧化钠和氧气;
B.饱和氢氧化钠溶液中加入过氧化钠和水反应生成氢氧化钠,会析出氢氧化钠晶体;
C.最后得到的是氢氧化钠溶液仍是饱和溶液,浓度不变;
D.生成的氢氧化钠会析出,饱和溶液中减少的水也会使氢氧化钠析出;
解答 解:A.过氧化钠和水反应生成氢氧化钠和氧气,氧气能使带火星的火柴梗复燃,故A正确;
B.饱和氢氧化钠溶液中加入过氧化钠和水反应生成氢氧化钠,会析出氢氧化钠晶体,故B正确;
C.最后得到的是氢氧化钠溶液仍是饱和溶液,溶液中溶质浓度不变,所以钠离子浓度不变,故C正确;
D.过氧化钠和水反应生成的氢氧化钠会析出,饱和溶液中减少的水也会使原饱和溶液中氢氧化钠析出,反应前后溶液中钠离子的质量发生改变,故D错误;
故选D.
点评 本题考查了过氧化钠性质、饱和溶液中离子浓度、溶质成分的分析判断,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
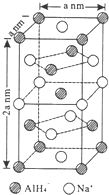 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
. 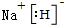 .
. 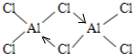 (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
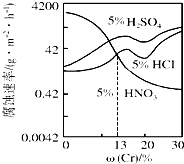 随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )| A. | 稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 | |
| B. | 随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 | |
| C. | Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 | |
| D. | 酸对Fe-Cr合金的腐蚀与阴离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
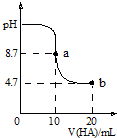 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | pH=7时,c(Na+)=0.05 mol•L-1 | |
| C. | a、b两点溶液中水电离出c(H+)浓度的比值为104 | |
| D. | b点所示溶液中c(A-)<c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
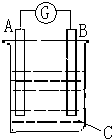 请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,
请根据图所示回答:甲装置是由铜、锌和稀硫酸组成的原电池,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com