
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
分析 (1)根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(N2);
4s时处于平衡状态,CO平衡浓度为2.70×10-3mol/L,转化率=$\frac{浓度变化量}{起始浓度}$×100%;
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(3)达到平衡时提高NO转化率,应使平衡向正反应移动,根据平衡移动原理结合选项解答,注意不能只增大NO的浓度;
(4)①利用控制变量法分析解答,Ⅰ、Ⅱ研究的是催化剂的比表面积对速率的影响,Ⅱ、Ⅲ的催化剂比表面积相同,研究的是温度对速率的影响,Ⅰ、Ⅲ催化剂的比表面积不同,温度不同,研究温度、催化剂的比表面积对反应速率的影响,
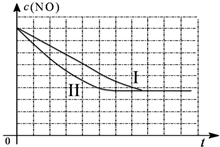
②绘图时,要注意达平衡的时间、平衡浓度的相对大小:Ⅱ与Ⅰ温度相同,平衡不移动,平衡浓度相同,但Ⅱ催化剂比表面积增大,达平衡时间短;
Ⅲ与Ⅱ的催化剂比表面积相同,Ⅲ温度高,温度升高,不仅达平衡时间缩短,平衡向左移动,使NO的平衡浓度也增大;
(5)已知CO的燃烧热为284kJ/mol,则:2CO(g)+O2?2CO2(g)△H=-568kJ/mol ①
又知:N2(g)+O2(g)═2NO(g)△H=+180kJ/mol ②
根据盖斯定律,①-②可得:2NO(g)+2CO(g)?2CO2(g)+N2(g).
解答 解:(1)v(NO)=$\frac{1×1{0}^{-3}mol/L-2.5×1{0}^{-4}mol/L}{2s}$=3.75×10-4mol/(L•s),速率之比等于化学计量数之比,所以v(N2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×3.75×10-4mol/(L•s)≈1.9×10-4mol/(L•s),
4s时处于平衡状态,CO平衡浓度为2.70×10-3mol/L,CO转化率=$\frac{3.6×1{0}^{-3}mol/L-2.7×1{0}^{-3}mol/L}{3.6×1{0}^{-3}mol/L}$×100%=25%,
故答案为:1.9×10-4mol/(L•s);25%;
(2)2NO(g)+2CO(g)?2CO2(g)+N2(g)的平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$,
故答案为:$\frac{{c}^{2}(C{O}_{2})×c({N}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$;
(3)A.催化剂不影响平衡的移动,故A错误,
B.该反应为放热反应,升高温度平衡向逆反应移动,NO的转化率降低,故B错误,
C.该反应为放热反应,降温平衡正向移动,NO转化率增大,故C正确,
D.缩小体积,增大压强,平衡向体积减小的方向运动,即正向移动,NO转化率增大,故D正确,
故答案为:CD;
(4)①利用控制变量法分析解答,Ⅰ、Ⅱ研究的是催化剂的比表面积对速率的影响,Ⅱ、Ⅲ的催化剂比表面积相同,研究的是温度对速率的影响,Ⅰ、Ⅲ催化剂的比表面积不同,温度不同,研究温度、催化剂的比表面积对反应速率的影响,故目的是:分别验证温度、催化剂比表面积对化学反应速率的影响规律,
故答案为:分别验证温度、催化剂比表面积对化学反应速率的影响规律;
②Ⅱ与Ⅰ温度相同,平衡不移动,平衡浓度相同,但Ⅱ催化剂比表面积增大,达平衡时间短,
Ⅲ与Ⅱ的催化剂比表面积相同,Ⅲ温度高,温度升高,不仅达平衡时间缩短,平衡向左移动,使NO的平衡浓度也增大,三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为: ,
,
故答案为: ;
;
(5)已知CO的燃烧热为284kJ/mol,则:2CO(g)+O2?2CO2(g)△H=-568kJ/mol ①
又知:N2(g)+O2(g)═2NO(g)△H=+180kJ/mol ②
根据盖斯定律,①-②可得:2NO(g)+2CO(g)?2CO2(g)+N2(g),则△H=-568kJ/mol-180kJ/mol=-748kJ/mol,
故答案为:-748kJ/mol.
点评 本题考查化学平衡的计算、化学平衡常数、平衡移动影响因素、影响速率因素探究实验、盖斯定律应用等,(4)中注意利用控制变量法分析解答,需要学生熟练掌握基础知识.


科目:高中化学 来源: 题型:选择题
| A. | H2发生还原反应 | B. | H2是还原剂 | C. | Cl2被氧化 | D. | Cl2发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 操 作 | 现 象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 可能含有的离子是①③⑥ | B. | 肯定没有的离子只有② | ||
| C. | 不能确定的离子只有⑤ | D. | 肯定含有的离子是①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、CO32- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | 含有大量NaClO的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 总反应可表示为2SO2+O2+2H2O$\stackrel{NO_{2}}{→}$2H2SO4 | |
| B. | 还可能发生的反应有4NO2+O2+2H2O→4HNO3 | |
| C. | NO2由反应N2+O2$\stackrel{放电}{→}$NO2生成 | |
| D. | 还可能发生的反应有4NO+3O2+2H2O→4HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色植物进行光合作用时,将太阳能转化为化学能“储存”起来 | |
| B. | 物质发生化学反应过程中一定伴随着能量变化 | |
| C. | 可将反应“NaOH+HCl═NaCl+H2O”的化学能通过原电池转化为电能 | |
| D. | 化学反应使放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com