
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
分析 (1)根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或二者的混合物;
(2)固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质;
(3)NO3-在酸性条件下具有强氧化性,可与Fe2+发生氧化还原反应;
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在;
C、溶液中氯离子浓度不变;
D、溶液中铁铜都有,说明铁离子和铁反应生成亚铁离子;
(5)在FeSO4的溶液中加入与FeSO4等物质的量的Na2O2固体,恰好使FeSO4转化为Fe(OH)3,反应的离子方程式为:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+.
解答 解:(1)根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,
故答案为:FeCl3;FeCl3和FeCl2;
(2)固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2,
故答案为:溶液变红色;FeCl2;
(3)NO3-在酸性条件下具有强氧化性,可与Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,溶液由浅绿色变为黄色,
故答案为:由浅绿色变为黄色;3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(4)A、铁还原性大于铜,铁有剩余,一定有铜剩余,只发生2Fe3++Fe=3Fe2+,依据铁离子物质的量0.02mol生成亚铁离子0.03mol,亚铁离子浓度c(Fe2+)=0.3mol/L,故A错误;
B、有铜无铁,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,当铜部分反应时,所以反应为2Fe3++Fe=3Fe2+,2Fe3++Cu=Cu2++2Fe2+,依据铁离子物质的量0.02mol则生成亚铁离子小于0.03mol,亚铁离子浓度c(Fe2+)小于0.3mol/L,故B错误;
C、溶液中氯离子浓度不变,烧杯中有Cu无Fe,说明铁全部反应生成亚铁离子,铜可能为反应或部分反应,溶液中铁离子不存在,溶液中c(Cl-)=0.6mol/L,故C正确;
D、溶液中铁铜都有,说明只发生2Fe3++Fe=3Fe2+,烧杯中Fe、Cu均有,说明铁离子全部反应,依据A计算得到c(Fe2+)=0.3mol/L,故D正确;
故选CD;
(5)在FeSO4的溶液中加入与FeSO4等物质的量的Na2O2固体,恰好使FeSO4转化为Fe(OH)3,反应的离子方程式为:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+,
故答案为:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+.
点评 本题考查了反应类推方法的应用,反应产物实验设计的应用,反应现象的判断,实验方案的设计,铁、铜、氯化铁溶液共存问题的分析判断离子浓度的计算,题目难度中等.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分子的电子式是H:O:Cl | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | O原子发生sp杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | CH3-CH2-CH2-CH2-OH | ||
| C. | CH2=CHCl | D. | 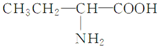 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子中存在共价键和分子间作用力 | |
| B. | 甲烷、氨和双氧水都是只由极性键结合而成的分子 | |
| C. | 同主族不同元素的最高价氧化物的水化物从上到下酸性递增 | |
| D. | 氟化氢的沸点高于氯化氢的沸点,水的沸点高于硫化氢的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C与14N含有相同的中子数 | |
| B. | 14C与C60是同分异构体 | |
| C. | 14C与C60中普通碳原子的化学性质不同 | |
| D. | 14C与12C互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com