
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题


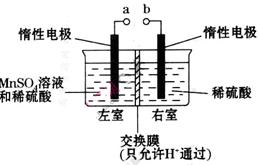
 个,左室溶液中
个,左室溶液中 的变化量为________________。
的变化量为________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.伴有能量变化的物质变化都是化学变化 | B.物质发生化学反应一定伴随着能量变化 |
| C.吸热反应在常温下不能发生 | D.放热反应的发生无需任何条件 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该反应可用于表示烧碱与硫酸反应 |
| B.该反应只有在加热条件下才能进行 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应可用于表示碳酸钙受热分解的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.吸热反应需要加热后才能发生 |
| D.反应物总能量和生成物总能量的相对大小决定了反应是放出还是吸收能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

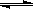 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g) △H = -9.48 kJ/mol
2HI(g) △H = -9.48 kJ/mol 2HI(g) △H = +26.48 kJ/mol
2HI(g) △H = +26.48 kJ/mol| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(1)的产物比反应(2)的产物稳定 |
| D.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) ΔH=+114.6 kJ/mol |
| B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) ΔH=-114.6 kJ/mol |
C.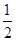 Ba(OH)2(aq)+HCl(aq)= Ba(OH)2(aq)+HCl(aq)=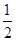 BaCl2(aq)+H2O(l) ΔH=-57.3 kJ/mol BaCl2(aq)+H2O(l) ΔH=-57.3 kJ/mol |
D.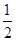 Ba(OH)2(aq)+HCl(aq)= Ba(OH)2(aq)+HCl(aq)=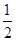 BaCl2(aq)+H2O(l) ΔH=+57.3 kJ/mol BaCl2(aq)+H2O(l) ΔH=+57.3 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com