
【题目】将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。
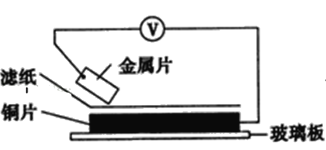
在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是( )
金属 | 电子流动方向 | 电压(V) |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.15 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定相同体积、浓度均为0.l mol·L-1的三种弱酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )

A.室温下,同浓度的NaA、NaB、NaD溶液的pH大小关系: pH(NaA)>pH(NaB)>pH(NaD)
B.滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D.当恰好中和时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是

A.与每个Ba2+距离相等且最近的Ba2+共有6个
B.晶体中Ba2+的配位数为8
C.晶体的化学式为Ba2O2
D.该氧化物是含有非极性键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中 不变
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为NiO2+ Fe+2H2O![]() Fe(OH)2+Ni(OH)2。下列有关该电池的说法中正确的是
Fe(OH)2+Ni(OH)2。下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.充电时阳板反应为Ni(OH)2+2OH--2e-=NiO2+2H2O
C.放电时正极附近溶液pH减小
D.充电时阴极附近溶液的碱性保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。
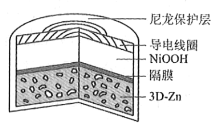
A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,现在向0.001 mol·L-1K2CrO4和0.01 mol·L-1KCl混合液中滴加0.01 mol·L-1AgNO3溶液,通过计算回答:
(1)Cl-、CrO42-谁先沉淀________?
(2)刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是________?(设混合溶液在反应中体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:


按以下合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了_____气体,继续滴加至液溴滴完,装置d的作用是______。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑。
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤,NaOH溶液洗涤的作用是_____。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的目的是_____。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为_______,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母)。
A. 重结晶 B. 过滤 C. 蒸馏 D. 萃取
(4)在该实验中,a的容积最适合的是_____(填入正确选项前的字母):
A. 25 mL B.50 mL C. 250 mL D. 500 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com