
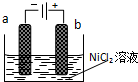
分析 (1)根据题意:制备Ni2O3的方法是电解NiCl2得Ni3+,在阳极上是Ni元素失电子的过程,据此判断阳极材料;
(2)硫酸钠是一种强电解质,溶液的导电能力强;
(3)根据电解池阴极上和阳极上的电极反应来判断;
(4)电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,据此书写方程式;
(5)原电池的正极上发生得电子的还原反应,电解池的阴极上发生得电子的还原反应;
(6)原电池的负极发生氧化反应,电解池的阴极反应的逆反应是氧化反应,据此确定充电时,电极的连接情况.
解答 解:(1)根据题意:制备Ni2O3的方法是电解NiCl2得Ni3+,在阳极上是Ni元素失电子的过程,所以阳极材料是惰性电极材料,故答案为:C;
(2)硫酸钠是一种强电解质,向其中加入硫酸钠,是为了增加离子浓度,增强溶液的导电能力,故答案为:增加离子浓度,增强溶液的导电能力;
(3)电解过程中,阴极反应:2H++2e-=H2↑,促进水的电离,氢氧根离子浓度增大,该极附近溶液的pH升高,阳极反应:2Cl-2e-=Cl2↑,电解过程中阳极附近生成的氯气与水反应生成盐酸和次氯酸,溶液的pH降低,故答案为:升高;降低;
(4)电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,即2Ni2++ClO-+H2O=2Ni3++Cl-+2OH-,故答案为:2Ni2++ClO-+H2O=2Ni3++Cl-+2OH-;
(5)①放电时,原电池的正极上发生得电子的还原反应Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,故答案为:Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-;
②充电时,电解池的阴极反应的逆反应是氧化反应:Fe(OH)2+2e-=Fe+2 OH-,故答案为:Fe(OH)2+2e-=Fe+2 OH-;
(6)二次电池充电时,电池的负极和电源的负极相连,故答案为:负极.
点评 本题考查了原电池、电解池的知识,该考点是高考考查的重点和难点,侧重于学生的分析能力的考查,本题有一定的综合性,难度适中.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||
| 2 | ① | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4、C2H4、C3H4 | |
| B. | CH4、C3H8、C2H2(C2H8、C2H2物质的量之比为1:3) | |
| C. | C2H6、C4H6、C2H2(物质的量之比为2:1:2) | |
| D. | C3H8、C4H8、C2H2(质量之比为11:14:26) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移时没有洗涤2~3次 | |
| B. | 定容时,俯视液面使之与刻度线相平 | |
| C. | 溶解时放出了大量的热,但未等温度恢复为常温就开始转移 | |
| D. | 转移溶液前,容量瓶不干燥,留下少量的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3-[] | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5[] | 3×10-5 | 2×10-5 |
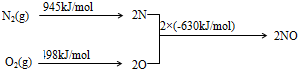
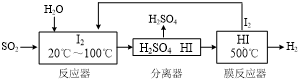
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,能使滴有酚酞的NaOH溶液褪色 | |
| B. | Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂 | |
| C. | MgO、Al2O3熔点高,可用于耐高温材料 | |
| D. | 常温下,铝与浓硝酸发生钝化,可用铝槽车贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
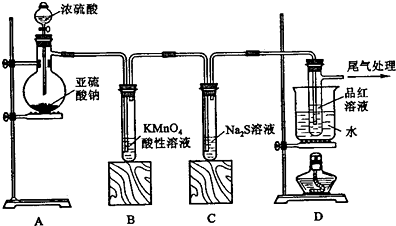
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com