
【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
(5)晶体有两种晶胞,如图1、图2所示。

图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。
【答案】![]()
![]()
![]()
![]()
![]()
![]() 或CO 12
或CO 12 ![]() 杂化转化为
杂化转化为![]() 杂化 小
杂化 小 ![]() 面心立方最密堆积
面心立方最密堆积 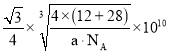
【解析】
(1)根据铁原子的价层电子排布式、泡利原理和洪特规则即可画出轨道表达式;
(2)同主族自上而下原子半径逐渐增大,第一电离能逐渐减小;原子晶体的熔沸点大于分子晶体;键长越短,键能越大,据此分析作答;
(3)等电子体可采用替换法进行解答;配位键也属于![]() 键,
键,![]() 中
中![]() 与
与![]() 形成6个配位键,即6个
形成6个配位键,即6个![]() 键,而
键,而![]() 中有1个
中有1个![]() 键,一共有6个
键,一共有6个![]() ,据此可算出
,据此可算出![]() 键的总键数;
键的总键数;
(4)CH4为正四面体结构,C原子采取![]() 杂化,键角为
杂化,键角为![]() ,
,![]() 为平面结构,C原子采取
为平面结构,C原子采取![]() 杂化,键角为
杂化,键角为![]() ,
,![]() 分子中1s与1s电子云重叠形成
分子中1s与1s电子云重叠形成![]() 键, 据此分析作答;
键, 据此分析作答;
(5)图1属于体心立方堆积,Fe原子配位数为8
(6)C原子与周围4个Si原子形成正四面体结构,碳化硅晶体内碳硅键的键长即为晶胞顶点Si原子与正四面体中心C原子之间的距离,二者连线处于晶胞体对角线上,距离等于晶胞体对角线长度的![]() ,而晶胞体对角线长度等于晶胞棱长的
,而晶胞体对角线长度等于晶胞棱长的![]() 倍,晶胞中C原子数目
倍,晶胞中C原子数目![]() 、Si原子数目
、Si原子数目![]() ,晶胞质量
,晶胞质量![]() ,根据晶胞的质量和密度可计算出晶胞的体积和晶胞的棱长,进而算出碳化硅晶体内碳硅键的键长,据此分析解答;
,根据晶胞的质量和密度可计算出晶胞的体积和晶胞的棱长,进而算出碳化硅晶体内碳硅键的键长,据此分析解答;
(1)基态铁原子的价层电子排布式为![]() ,由泡利原理、洪特规则,轨道表达式为:
,由泡利原理、洪特规则,轨道表达式为:![]() ;
;
故答案为:![]() ;
;
(2)①同主族自上而下原子半径增大,故原子半径:![]() ;
;
故答案为:![]() ;
;
②同主族自上而下第一电离能减小,故第一电离能:![]() ;
;
故答案为:![]() ;
;
③CO2属于分子晶体,而![]() 属于原子晶体,故熔点:
属于原子晶体,故熔点:![]() ;
;
故答案为:![]() ;
;
④C-H的键长比![]() 键的短,故键能:
键的短,故键能:![]() ;
;
故答案为:![]() ;
;
![]() 用N原子替换C原子与1个单位负电荷,或者用O原子替换N原子与1个单位负电荷,得到与
用N原子替换C原子与1个单位负电荷,或者用O原子替换N原子与1个单位负电荷,得到与![]() 互为等电子体的分子为:
互为等电子体的分子为:![]() 或CO;
或CO;![]() 中
中![]() 与
与![]() 形成6个配位键,
形成6个配位键,![]() 中有span>1个
中有span>1个![]() 键,故
键,故![]() 中共有12个
中共有12个![]() 键,1
键,1![]() 中含
中含![]() 键;
键;
故答案为:![]() 或CO;12;
或CO;12;
![]() 为正四面体结构,C原子采取
为正四面体结构,C原子采取![]() 杂化,
杂化,![]() 为平面结构,C原子采取
为平面结构,C原子采取![]() 杂化,碳原子的杂化类型转化过程为:
杂化,碳原子的杂化类型转化过程为:![]() 杂化转化为
杂化转化为![]() 杂化;
杂化;![]() 分子中1s与1s电子云重叠形成
分子中1s与1s电子云重叠形成![]() 键,从共价键重叠方式看,
键,从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为
键类型为![]() 键;甲烷分子中键角为
键;甲烷分子中键角为![]() ,乙烯中键角约是
,乙烯中键角约是![]() ,
,![]() 的键角比
的键角比![]() 的键角小;
的键角小;
故答案为:![]() 杂化转化为
杂化转化为![]() 杂化;
杂化;![]() 键;小;
键;小;
![]() 图1中体心Fe原子与位于顶点的Fe原子相邻,Fe原子配位数为8;图2中Fe原子处于面心、顶点,属于面心立方最密堆积;
图1中体心Fe原子与位于顶点的Fe原子相邻,Fe原子配位数为8;图2中Fe原子处于面心、顶点,属于面心立方最密堆积;
故答案为:8;面心立方最密堆积;
![]() 原子与周围4个Si原子形成正四面体结构,碳化硅晶体内碳硅键的键长即为晶胞顶点Si原子与正四面体中心C原子之间的距离,二者连线于晶胞体对角线上,距离等于晶胞体对角线长度的
原子与周围4个Si原子形成正四面体结构,碳化硅晶体内碳硅键的键长即为晶胞顶点Si原子与正四面体中心C原子之间的距离,二者连线于晶胞体对角线上,距离等于晶胞体对角线长度的![]() ,而晶胞体对角线长度等于晶胞棱长的
,而晶胞体对角线长度等于晶胞棱长的![]() 倍,晶胞中C原子数目
倍,晶胞中C原子数目![]() ,Si原子数目
,Si原子数目![]() ,晶胞质量
,晶胞质量![]() ,晶胞体积
,晶胞体积![]()
![]()
![]() ,晶胞棱长
,晶胞棱长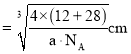 ,故碳化硅晶体内碳硅键的键长
,故碳化硅晶体内碳硅键的键长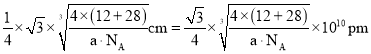 ;
;
故答案为: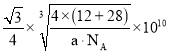 ;
;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,
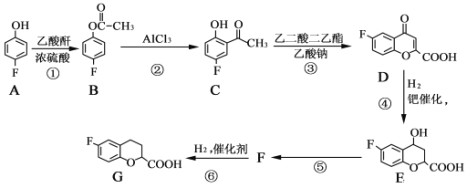
已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)B的分子式为______________,反应①的反应类型为________________
(2)C所含官能团的名称为__________________________________________。
(3)反应⑤的化学方程式为_________________,该反应的反应类型是_________________。
(4)写出满足下列条件的E的同分异构体的结构简式:___________、______________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备 的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)_____________。(合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OHCH3COOCH2CH3)
CH3CH2OHCH3COOCH2CH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为____________;
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能I1从大到小顺序为(用元素符号表示)_______________________________;用原子结构观点加以解释_________________________。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具 有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3NH3 。BF3NH3中B原子的杂化轨道类型为__________,N原子的杂化轨道类型为 ______________ ,B与 N之间形成 __________________ 键。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构;金刚砂晶体属于____________(填晶体类型)在SiC结构中,每个C原子周围最近的C原子数目为 ______________。
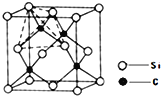
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:K2SO4·MgSO4·2CaSO4 (s)![]() 2Ca2++2K++Mg2++4SO42-。不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是
2Ca2++2K++Mg2++4SO42-。不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是

A.该平衡的Ksp=c2(Ca2+)·c2(K+)·c(Mg2+)·c4(SO42-)B.向该体系中加入饱和K2SO4溶液,溶解平衡向左移动 C.升高温度,溶浸速率增大,平衡向正反应方向移动 D.向该体系中加入饱和NaOH溶液,溶解平衡不发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水仙花所含的挥发油中含有丁香油酚、苯甲醇、苯甲醛、桂皮醇等成分。它们的结构简式如下:
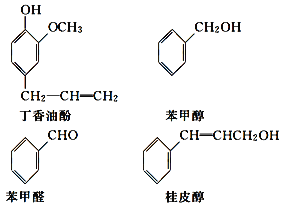
请回答下列问题:
(1)①丁香油酚中含氧的官能团是_____;丁香油酚可能具有的性质是_____(填字母)。
A.可与烧碱反应
B.只能与Br2发生加成反应
C.既可燃烧,也可使酸性KMnO4溶液褪色
D.可与NaHCO3溶液反应放出CO2气体
②从结构上看,上述四种有机物中与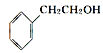 互为同系物的是____(填名称)。
互为同系物的是____(填名称)。
(2)苯甲醛经________(填反应类型)反应可得到苯甲醇。写出苯甲醛和银氨溶液反应化学方程式为___________________________________。III
(3)由桂皮醇转化为丙的过程为(已略去无关产物)
桂皮醇![]()
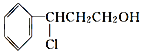
![]() 甲
甲![]() 乙
乙![]() 丙
丙
如果反应Ⅱ为消去反应,则反应Ⅱ的条件是_______________,反应Ⅲ为加聚反应,则高聚物丙的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定环境中能大量共存的是( )
A.在 =1013的溶液中:NH4+、Ca2+、Cl-、K+
=1013的溶液中:NH4+、Ca2+、Cl-、K+
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、K+
C.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液中:Al3+、NH4+、Cl-、S2-
B.使酚酞显红色的溶液中:Na+、ClO-、CO32-、NO3-
C.0.1mol·L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42-
D.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Fe2+、Cu2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-、Br-、
、Cl-、Br-、![]() 中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )

A.Ba2+、Fe3+、![]() 、
、![]() 肯定不存在,Na+、K+肯定存在
肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含![]() 和
和![]()
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含![]() 需另做实验判断
需另做实验判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com