
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,原电池工作时,电子从负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动.
解答 解:①、通入CH4的电极为负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,每消耗1molCH4可以向外电路提供8mole-,故①正确;
②、通入CH4的电极为负极失电子反应氧化反应,电极反应为:CH4+10OH--8e-=CO32-+7H2O,故②正确;
③通入氧气的一极为原电池的正极,得到电子发生还原反应:O2+2H2O+4e-=4OH-,故③错误;
③、电池反应式为:CH4+2OH-+2O2=CO32-+3H2O,随着反应的进行,溶液中氢氧根离子不断减少,溶液pH不断减小,所以该电池使用一段时间后应补充KOH,故④错误;
故选D.
点评 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累电子、电流、离子的流向.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
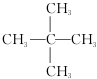
| A. | 分子不可能是烷烃 | B. | 分子中C、H个数之比为1:4 | ||
| C. | 分子中可能含有氧原子 | D. | 此有机物的最简式为CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
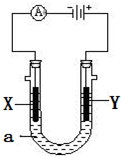 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钠 | D. | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变不同 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com