
 工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作: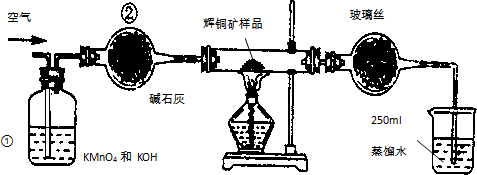
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
分析 实验原理是Cu2S+O2$\frac{\underline{\;\;△\;\;}}{\;}$SO2+2Cu反应产生的二氧化硫被水吸收,用高锰酸钾来滴定,通过消耗高锰酸钾的量来计算Cu2S的质量,进而计算Cu2S的质量分数.
(1)装置①中是高锰酸钾溶液与氢氧化钾溶液的混合溶液,目的是为了吸收空气中可能含有的二氧化硫气体;装置②干燥管中的氯化钙是干燥气体的作用;
(2)高锰酸钾具有氧化性,可以氧化亚硫酸为硫酸,锰被还原为锰离子,据此写出反应方程式;
(3)依据反应Cu2S+O2$\frac{\underline{\;\;△\;\;}}{\;}$SO2+2Cu、2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O;
依据反应定量关系计算;5Cu2S~5SO2~5H2SO3~2KMnO4;
(4)二氧化硫具有还原性,空气中氧气也可把二氧化硫氧化;
(5)根据硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度;
(6)该装置是原电池,负极上的二氧化硫失电子发生氧化反应.
解答 解:(1)装置①中溶液是高锰酸钾溶液与氢氧化钾溶液的混合溶液,目的是为了吸收空气中可能含有的二氧化硫气体,避免对测定结果产生误差;装置②干燥管中的氯化钙是除去混有的水蒸汽,干燥气体的作用,
故答案为:除去空气中可能含有的SO2等气体;干燥气体;
(2)高锰酸钾具有氧化性,可以氧化亚硫酸为硫酸,高锰酸钾被还原为硫酸锰,反应的方程式为:2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O,故答案为:2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O;
(3)若称得矿样的质量为1.000g,第3组数据误差太大,舍去,前两组消耗高锰酸钾溶液的平均体积为:
$\frac{(21.03-1.04)+(21.99-1.98)}{2}$mL=20.00mL,浓度为0.0100mol/L,高锰酸钾的物质的量=0.0100mol•L-1×0.0200L=2.000×10-4mol;依据反应定量关系计算;
5Cu2S~5SO2~5H2SO3~2KMnO4
5 2
n 2.000×10-4mol
n=5×10-4mol
则辉铜矿样品中Cu2S的质量分数是=$\frac{5×10{\;}^{-4}mol×160g/mol×\frac{250}{25}}{1.000g}$×100%=80%;
故答案为:80%.
(4)二氧化硫具有还原性,空气中氧气没有除去,会把二氧化硫部分氧化,则和高锰酸钾反应的二氧化硫减少,造成结果偏低,故答案为:在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低;
(5)溶液中c(S2-)=$\frac{Ksp}{c(Fe{\;}^{2+})}$=6.25×10-18mol/L,c2(H+)•c(S2-)=1.0×10-22,则c(H+)=$\sqrt{\frac{1×10{\;}^{-22}}{6.25×10{\;}^{-18}}}$mol/L=4×10-3mol/L,
故答案为:4×10-3mol/L;
(6)负极上,二氧化硫失电子和水反应生成硫酸,电极反应式为:SO2-2e-+2H2O=SO42-+4H+,
故答案为:SO2-2e-+2H2O=SO42-+4H+.
点评 本题考查了物质性质的探究实验设计和过程分析判断,滴定计算及误差分析、沉淀溶解平衡的计算、原电池原理等,搞清原理和物质性质是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO$\stackrel{HCl(ag)}{→}$MgCl2(ag)$\stackrel{△}{→}$无水MgCl2 | |
| B. | Al2O3$\stackrel{NaOH(ag)}{→}$NaAlO2(ag)$\stackrel{HCl(ag)}{→}$AlCl3 | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 | |
| D. | Cu$\stackrel{稀HNO_{3}}{→}$NO2$\stackrel{H_{2}O}{→}$NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-═2I2+2H2O | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 碳酸氢镁溶液中加入足量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .反应②的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
.反应②的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com