
| A. | NaOH和Na2O2 | B. | NaOH和Na2CO3 | C. | Na2CO3 | D. | Na2O2 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯加到溴水中,将会和溴发生取代反应而使溴水褪色 | |
| B. | 用冷却结晶法来提纯含少量KCl杂质的KNO3晶体 | |
| C. | 将10%的葡萄糖溶液加到新制氢氧化铜悬浊液中,出现砖红色沉淀 | |
| D. | 进行淀粉水解实验时,为检验水解产物和水解程度,加液顺序为淀粉溶液→H2SO4溶液→NaOH溶液→碘水→新制Cu(OH)2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药的使用 | B. | 用铁矿石炼铁 | ||
| C. | 打磨磁石制备指南针 | D. | 造纸术的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO- Na+ CH3COOH | B. | CH3COO- CH3COOH H+ | ||
| C. | CH3COOH OH- H+ | D. | CH3COO- OH- H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3过量 | B. | Na2CO3恰好与醋酸完全反应 | ||
| C. | 两种酸都过量 | D. | 两种酸的物质的量浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
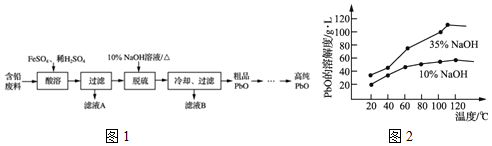
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Na+由负极向正极移动 | |
| B. | 充电时,阴极反应式为Na++e-═Na | |
| C. | 电解质溶液可选NaClO4水溶液 | |
| D. | 电池放电时把二氧化碳变废为宝,有重要的研发意义 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com