
| A. | Al3+ Ag+ NO3- Cl- | B. | Mg2+NH4+ NO3- I- | ||
| C. | Ba2+K+ S2- Cl- | D. | Zn2+ Na+ NO3- SO42- |
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
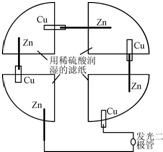 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | Zn都是负极,发生还原反应 | ||
| C. | 电子都是从铜片经外电路流向锌片 | D. | 该装置至少有两种形式的能量转换 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一次性塑料袋使用方便又经济,应大力提倡生产和大量使用 | |
| B. | 推广利用太阳能、风能,缓解温室效应 | |
| C. | 采用焚烧的方法处理农作物秸秆和垃圾 | |
| D. | 大力开采金属矿物资源,保障金属材料的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(5) | B. | (1)(3)(5) | C. | (1)(4)(5) | D. | (2)(3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该1体积盐酸中加入2体积水 | |
| B. | 将该1体积盐酸加水冲稀到3体积 | |
| C. | 将该盐酸与pH=12的氢氧化钠溶液以1:9的体积比混合 | |
| D. | 取该1体积盐酸加100体积水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、NO3-、Cl- | B. | NH4+、K+、HCO3-、OH- | ||
| C. | Na+、Al3+、AlO2-、Cl- | D. | K+、Mg2+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
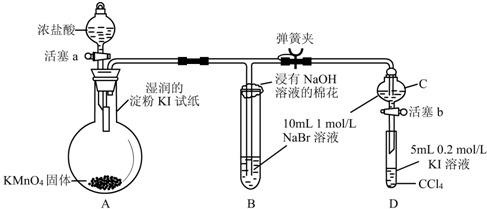
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
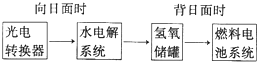
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com