
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
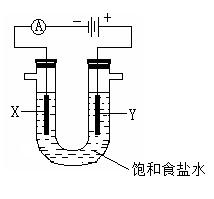
 C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:Y>Z >R>T |
| B.气态氢化物的稳定性:W<R<T |
| C.最高价氧化物对应的水化物的碱性:X>Z |
| D.XR2和WR2两化合物中R的化合价相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A的氢化物 | B的氢化物 | M的氢化物 | X的氧化物 | Y的氢化物分子构型 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 正四面体 | 对应水化物为最强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.砷通常情况下是固体 | B.砷可以有-3、+3、+5等多种化合价 |
| C.As2O5对应水化物酸性比H3PO4弱 | D.砷的非金属性比磷强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④ | B.③④ | C.①③④ | D.① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素的化学性质主要决定于原子的核外电子数 |
| B.氯化氢溶于水能导电,但液态氯化氢不能导电 |
C.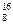 O、 O、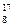 O和 O和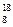 O互为同位素,均属于氧元素,且性质相同 O互为同位素,均属于氧元素,且性质相同 |
| D.导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子的还原性:Y2->Z- | B.质子数:c>b |
| C.氢化物的稳定性:H2Y>HZ | D.原子半径:X<W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com