
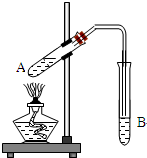
 某同学在实验室用下图所示实验装置制取乙酸乙酯.回答下列问题:
某同学在实验室用下图所示实验装置制取乙酸乙酯.回答下列问题:

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若固体完全溶解,则粉末中不可能有Cu2O |
| B、若固体不能完全溶解,则粉末中肯定有Cu2O |
| C、若固体完全溶解,溶液中再加KSCN,变红,则原粉末仅是Fe2O3 |
| D、若固体不能完全溶解,溶液中再加KSCN,不变红,则原粉末仅是Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
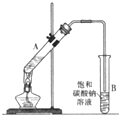 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 与水混溶 | 与乙醚混溶 | 微溶于水 |
| 浓硫酸 |
| 140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
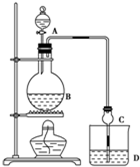 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
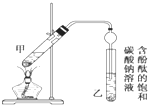 某学生在实验室制取乙酸乙酯的主要步骤如下:
某学生在实验室制取乙酸乙酯的主要步骤如下:| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
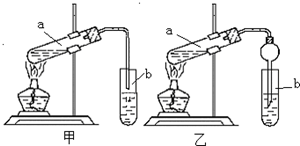 某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题:
某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com