
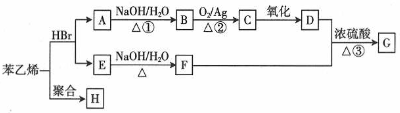
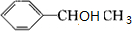 ;H的结构简式
;H的结构简式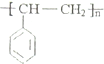 .
.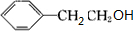 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2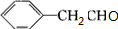 +2H2O ③
+2H2O ③ +
+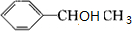 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$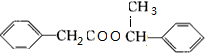 +H2O
+H2O .(任写一种)
.(任写一种)分析 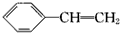 与HBr发生加成反应可生成
与HBr发生加成反应可生成 、
、 ,由转化关系可知A为
,由转化关系可知A为 ,E为
,E为 ,则B为
,则B为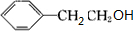 ,C为
,C为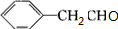 ,D为
,D为 ,F为
,F为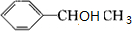 ,G为
,G为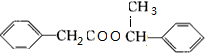 ,H为
,H为 ,结合对应物质的结构和性质以及题目要求解答该题.
,结合对应物质的结构和性质以及题目要求解答该题.
解答 解: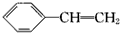 与HBr发生加成反应可生成
与HBr发生加成反应可生成 、
、 ,由转化关系可知A为
,由转化关系可知A为 ,E为
,E为 ,则B为
,则B为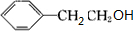 ,C为
,C为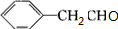 ,D为
,D为 ,F为
,F为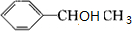 ,G为
,G为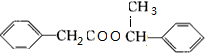 ,H为
,H为 ,
,
(1)A为 ,发生取代反应生成
,发生取代反应生成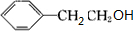 ,
,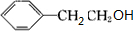 含有的官能团为羟基,
含有的官能团为羟基,
故答案为:取代反应;羟基;
(2)由以上分析可知F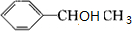 ,H为
,H为 ,故答案为:
,故答案为: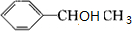 ;
; ;
;
(3)B为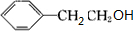 ,含有羟基,在银催化作用下可发生氧化反应生成
,含有羟基,在银催化作用下可发生氧化反应生成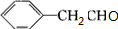 ,反应的化学方程式为2
,反应的化学方程式为2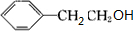 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2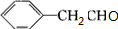 +2H2O,③为酯化反应,反应的方程式为
+2H2O,③为酯化反应,反应的方程式为 +
+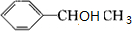 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$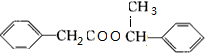 +H2O,
+H2O,
故答案为:2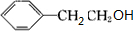 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2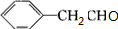 +2H2O;
+2H2O; +
+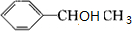 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$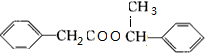 +H2O;
+H2O;
(4)A为 ,核磁共振氢谱有5组峰,峰面积之比为1:2:2:2:2,
,核磁共振氢谱有5组峰,峰面积之比为1:2:2:2:2,
故答案为:5;1:2:2:2:2;
(5)F为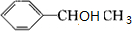 ,对应的同分异构体①可与FeCL3溶液能发生显色反应,说明含有酚羟基,②苯环上有三个取代基,③苯环上的一氯代物有两种,说明苯环含有2个甲基,且结构对称,应为
,对应的同分异构体①可与FeCL3溶液能发生显色反应,说明含有酚羟基,②苯环上有三个取代基,③苯环上的一氯代物有两种,说明苯环含有2个甲基,且结构对称,应为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,为高频考点和常见题型,侧重于学生的分析能力的考查,注意把握题给信息,把握有机物的结构以及官能团的性质,易错点为同分异构体的判断,注意把握有机物的结构特点,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )| A. | 1 mol、2 mol | B. | 1 mol、4 mol | C. | 3 mol、2 mol | D. | 3 mol、4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白液中通入少量二氧化碳:ClO-+H2O+CO2═${CO}_{3}^{2-}$+2HClO | |
| B. | 常温时偏铝酸钠溶液pH>7:${AlO}_{2}^{-}$+2H2O═Al(OH)3↓+OH- | |
| C. | 等物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| D. | 向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至沉淀完全:H++${SO}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{125a}{72V}$ mol•L-1 | B. | $\frac{125a}{36V}$ mol•L-1 | C. | $\frac{250a}{36V}$ mol•L-1 | D. | $\frac{250a}{48V}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
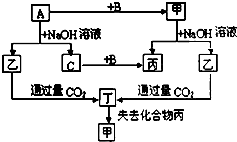 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图的转化关系,已知C为密度最小的气体,甲为非电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图的转化关系,已知C为密度最小的气体,甲为非电解质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质物质的量之比为2:7的三氯化铝溶液和氢氧化钡溶液混合2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 将溶质物质的量之比为4:3的 硫酸氢钠和氢氧化钡溶液两溶液混合:4H++3SO42-+3Ba2++4OH-═3BaSO4↓+4H2O | |
| C. | 用石墨电极电解碘化镁溶液 2 I--2 e-=I 2 | |
| D. | 将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20 H++5NO3-═3Fe2++3Fe3++5NO↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O | |
| B. | 碳酸氢钠溶液中加入足量热的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| C. | 用氯酸钠的酸性溶液与H2O2作用制取ClO2:4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O | |
| D. | 用硫酸酸化的桔红色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com