
分析 (1)a保持容积不变,b保持内外压强相等,反应3A(g)+B(g)?2C(g)+D(g)是气体物质的量减少的反应,平衡时a中压强比b中小,故b相当于在a平衡的基础上加压,平衡右移,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡;
(2)改变起始投料比,要想达到平衡后a中C的浓度仍为N mol•L-1,恒温恒容下,与原平衡是完全等效平衡,按化学计量数转化到方程式左边,满足与原平衡中相同物质的起始投料量相等;
b中C的浓度为n mol•L-1,与原平衡为等效平衡,等温等压的条件下,按化学计量数转化到方程式左边,满足与原平衡中物质的投料量比;
(3)若将2molC和2molD充入a中,等效为开始投入3molA(g)、1molB(g)、1molD(g),与原平衡相比平衡逆向移动;
(4)将4 mol C和2 mol D充入a中相当于开始充入6 mol A、2 mol B,压强增大,平衡向右移动,反应物转化率增大,参加反应的A的物质的量大于原平衡的2倍,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡.
解答 解:(1)a保持容积不变,b保持内外压强相等,反应3A(g)+B(g)?2C(g)+D(g)是气体物质的量减少的反应,平衡时a中压强比b中小,故b相当于在a平衡的基础上加压,平衡右移,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,故b中平衡时A的浓度大于a中A的平衡浓度,即M<m,平衡右移,b中C的平衡浓度高于a中C的平衡浓度,即N<n,
故答案为:<,<;
(2)改变起始投料比,要想达到平衡后a中C的浓度仍为N mol•L-1,恒温恒容下,与原平衡是完全等效平衡,按化学计量数转化到方程式左边,满足与原平衡中相同物质的起始投料量相等,选项中DE符合;
b中C的浓度为n mol•L-1,与原平衡为等效平衡,等温等压的条件下,按化学计量数转化到方程式左边,满足与原平衡中物质的投料量比,选项中ADE符合,
故答案为:DE;ADE;
(3)若将2molC和2molD充入a中,等效为开始投入3molA(g)、1molB(g)、1molD(g),与原平衡相比平衡逆向移动,故平衡时A的浓度增大,C的浓度减小,即W>M、Y<N,
故答案为:>;<;
(4)将4mol C和2 mol D充入a中相当于开始充入6 mol A+2 mol B,压强增大,平衡向右移动,反应物转化率增大,参加反应的A的物质的量大于原平衡的2倍,平衡时A的浓度小于原平衡的2倍,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,故M<R<2M,
故选:C.
点评 本题考查化学平衡移动与计算,难度中等,注意利用等效思想设计平衡建立的途径,理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 由于电流的作用,酸、碱、盐溶于水发生电离 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 向氢氧化铁胶体中滴加稀硫酸,开始时产生沉淀,继续滴加时沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
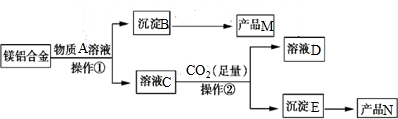
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )
如图所示的装置常用于制取气体并检验气体的性质.下列有关说法正确的是( )| A. | 关闭分液漏斗的活塞.将干燥管末端放人水中,微热烧瓶,有气泡从水中冒出,停止加热后,燥管内有水柱形成,表明装置不漏气 | |
| B. | 若装置用于制取氯气并验证其具有漂白性,则A中所用试剂为稀盐酸,B中所用药品为KMnO4固体,C中为品红溶液 | |
| C. | 若装置用于制取SO2并验证其具有漂白性,则A中所用试剂为浓硫酸,B中所用药品为Na2SO3固体,C中为酸性KMnO4溶液 | |
| D. | 若实验时B中盛放固体NaOH,A中为浓氨水,C中为稀AgNO3溶液,则实验过程中,C试管中看不到明显的实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
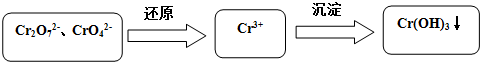
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | c(HCO${\;}_{3}^{-}$)>c(ClO-)>c(OH-) | |
| C. | c(HClO)+c(ClO-)=c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(ClO-)+c(OH-)+c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
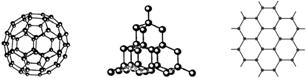
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com