
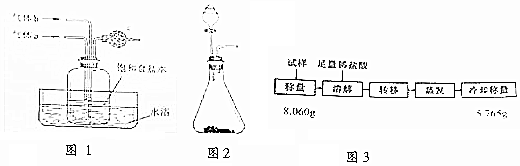
分析 A.称量时,砝码先大后小;
B.蒸馏时温度计测定馏分的温度;
C.配制溶液时,不能在容量瓶中稀释浓硫酸;
D.稀硫酸不挥发,干扰实验;
E.蒸发时利用余热加热;
F.分液时避免上下层液体混合;
G.冷凝管中水下进上出停留时间长,冷却效果好.
解答 解:A.称量时,砝码先大后小,则称量物体时,先加质量大的砝码,再加质量小的砝码,故A正确;
B.蒸馏时温度计测定馏分的温度,则温度计水银球靠近蒸馏烧瓶的支管口处,故B正确;
C.配制溶液时,不能在容量瓶中稀释浓硫酸,应在烧杯中稀释冷却后转移到容量瓶中,故C错误;
D.稀硫酸不挥发,干扰实验,应选稀盐酸洗涤,故D错误;
E.蒸发时利用余热加热,则不能蒸干,故E错误;
F.分液时避免上下层液体混合,则分液漏斗中下层液体从下口放出,上层液体从上口倒出,故F正确;
G.冷凝管中水下进上出停留时间长,冷却效果好,则冷水应从下口进上出,故G错误;
故答案为:CDEG.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、混合物分离提纯、溶液配制为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A | 实验操作 | 预测的实验现象 |
| B | 向Na2CO3溶液中滴加盐酸 | 立即有气体逸出 |
| C | 将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口 | 试纸褪色 |
| D | 铅箔在酒精灯火焰上加热 | 铝熔化但不会滴下 |
| 向淀粉的水解液中加入新制Cu(OH)2悬浊液并加热 | 一定有砖红色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 用途或反应 | 硫酸或硝酸表现的性质 |
| (1)用稀硫酸和锌粒制氢气 | |
| (2)用浓硫酸和食盐固体制氯化氢 | |
| (3)用稀硝酸洗涤试管壁上附着的银 | |
| (4)浓硫酸、浓硝酸可用钢瓶贮运 | |
| (5)久置的浓硝酸显黄色 | |
| (6)打开浓硝酸瓶塞时,瓶口有白雾生成 | |
| (7)敞口的浓硫酸,放置一段时间后质量变大 | |
| (8)浓硫酸可使湿润的蓝色石蕊试纸先变红,后变黑 | |
| (9)浓硝酸可使湿润的蓝色石蕊试纸先变红,后褪色 | . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③⑥ | C. | ②④⑤ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏、液化都是化学变化 | |
| B. | 工业上可通过石油分馏直接得到甲烷、乙烯和苯 | |
| C. | 乙酸和甲酸甲酯不互为同分异构体 | |
| D. | 乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①④②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com