
【题目】(1)我国是世界上最早使用湿法炼铜的国家。湿法炼铜的原理是Fe+CuSO4=FeSO4+Cu,其中铁被__________(填“氧化”或“还原”),CuSO4作________(填“氧化”或“还原”)剂。在该反应中,若生成了1 mol Cu,消耗Fe的物质的量是_________。
(2)某学习小组设计下图所示装置观察氧化还原反应中电子的转移。
实验Ⅰ | 实验Ⅱ | |
装置 |
|
|
现象 | 电流计指针向右偏转;铁片溶解; 铜片上有红色物质(铜)析出,铜片质量增加 | 电流计指针向右偏转;…… |
①实验Ⅰ中,Fe与CuSO4溶液反应的离子方程式是______________。
②根据实验Ⅰ的原理,推测实验Ⅱ中:锌片上发生_________(填“氧化”或“还原”)反应;铜片上的实验现象是__________。
【答案】氧化 氧化 1mol Fe+Cu2+=Cu+Fe2+ 氧化 产生无色气泡
【解析】
(1)反应中Fe元素的化合价升高,Fe失去电子,Cu元素的化合价降低,Cu得到电子,据此判断;
(2)①实验Ⅰ中,Fe与CuSO4溶液发生原电池反应,Fe失去电子,铜离子得到电子;
②根据实验Ⅰ的原理,推测实验Ⅱ中Zn失去电子,氢离子得到电子。
(1)湿法炼铜的原理是Fe+CuSO4=FeSO4+Cu,其中铁失去电子被氧化,Cu得到电子,CuSO4作氧化剂。由反应可知,若生成了1mol Cu,消耗Fe的物质的量是1mol;
(2)①铁的金属性强于铜,实验Ⅰ中,Fe与CuSO4溶液发生原电池反应,Fe失去电子,铜离子得到电子,则Fe与CuSO4溶液反应的离子方程式是Fe+Cu2+=Cu+Fe2+;
②锌的金属性强于铜,根据实验Ⅰ的原理,推测实验Ⅱ中Zn失去电子,氢离子得到电子,则锌片上发生氧化反应;铜片上氢离子得到电子生成氢气,即实验现象是产生无色气泡。


科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工农业发展,NH4Cl的需求显著降低,价格低迷和产品积压导致利用“侯氏制碱法”生产的碱厂出现亏损。新联合制碱法在此基础上将氯元素转化为更有应用价值的HCl。

(1)气体X是__________。
(2)已知25℃时部分物质的溶解度数据:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 10.3 | 39.5 | 24.8 |
结合表中数据说明过程Ⅰ中的反应能发生的原因是______________。
(3)过程Ⅰ获得的NaHCO3会吸附微量NH4Cl,导致产品Na2CO3中混有NaCl。
①用化学方程式表示过程Ⅱ中NaCl生成的原因:_____________。
②检验Na2CO3中NaCl的实验操作是,取少量固体于试管中_____________。
(4)过程Ⅲ以MgO为催化剂,在不同温度下加热灼烧,将NH4Cl分解为NH3和HCl。

①步骤i中反应的化学方程式是____________。
②过程Ⅲ的优点是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤产生的SO2会污染空气。某实验小组用下图装置(夹持仪器略、气密性好)探究SO2的性质,并研究治理措施。

(1)装置①中反应的化学方程式是_______________。
(2)从物质类别的角度分析,SO2和CO2具有相似的化学性质,欲验证该性质,②中可选用的试剂及预期的实验现象是_________________。
(3)当②中为氢硫酸(溶质为H2S)时,观察到②中出现黄色沉淀,说明SO2具有的化学性质是_______________。
(4)当②中为碘水时,观察到②中溶液由黄色变为无色,由此推测所得无色溶液中的离子主要是H+、I-和_________;通过进一步实验证实了该过程中SO2已被氧化,实验操作及现象是______________。
(5)结合SO2的性质,请你针对煤的使用及其产生的环境污染提出一条解决或缓解的建议:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备,正丁烷(C4H10)催化脱氢制1-丁烯(C4H8) 的化学方程式如下:C4H10(g)=C4H8(g)+H2(g)△H,如图是该反应平衡转化率与反应温度及压强的关系图,下列说法正确的是
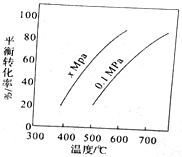
A. x>0.1
B. △H>O
C. 500C时,压强xMPa比0.1MPa条件下的平衡常数大
D. 一定温度下,在一恒容密闭容器中发生该反应,C4H10的浓度越高,平衡转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是__________________________________________________。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______________________________。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2 mol·L-1, c(Fe3+)=1.0×10-3 mol·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为________。
②完成NaClO3氧化FeCl2的离子方程式:
![]() ClO3-+
ClO3-+![]() Fe2++________===
Fe2++________===![]() Cl-+
Cl-+![]() Fe3++
Fe3++![]() ________,______________
________,______________
(3)FeCl3在溶液中分三步水解:
Fe3++H2O ![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是________________。
通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)
Fex(OH)![]() +yH+,欲使平衡正向移动可采用的方法是(填序号)________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)________。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
(4)天津某污水处理厂用聚合氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为________mg·L-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com