
分析 (1)根据方程式,失电子的物质作负极;电解质溶液中含有得电子的Ag+;
(2)得电子的物质在正极上反应,结合方程式判断得电子的离子,从而写出电极反应式;
(3)根据正极反应式计算Ag的物质的量,带入m=nM计算质量.
解答 解:(1)原电池中失电子的物质作负极,根据反应方程式知,Cu作负极,电解质溶液中含有得电子的Ag+,可用硝酸银溶液作电解质溶液,
故答案为:Cu;硝酸银溶液;
(2)在正极上银离子得电子生成银单质,电极反应式为Ag++e-=Ag,
故答案为:Ag++e-=Ag;
(3)由Ag++e-=Ag可知,导线上转移电子1mol,则生成1molAg,质量为1mol×108g/mol=108g,
故答案为:108.
点评 本题考查原电池的设计,题目难度不大,注意两极材料的判断以及电极反应式的书写方法.


科目:高中化学 来源: 题型:解答题
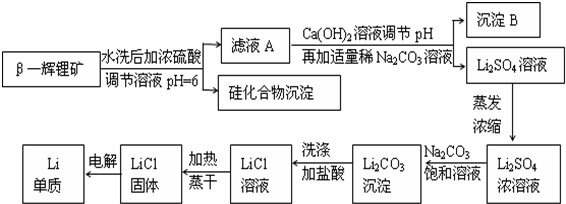
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
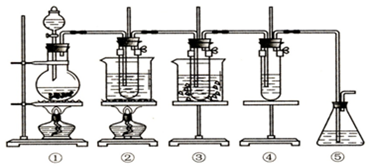
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
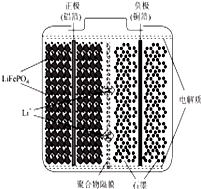 锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.
锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
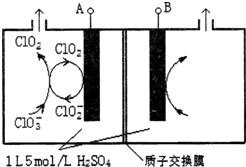 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第0族 | B. | 第四周期第ⅠA族 | C. | 第三周期第ⅠA族 | D. | 第三周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| C. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| D. | 为确定是否含有Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 《西游记》中孙悟空一个“筋头云”,十万八千里,其乃“腾云驾雾”而行,其中的云不是胶体,雾是胶体 | |
| B. | 《水浒》中经典片段-----智劫生辰纲中,晁盖等人用蒙汗药药倒杨智等人.其使用的蒙汗药的主要成份可能是NaCN | |
| C. | 《三国演义》中,诸葛亮擒拿南王孟获时路遇哑泉,人饮用了哑泉水后,一个个说不出话来,其主要成份是CuSO4.智者指教,饮安乐泉水可解毒,安乐泉水主要成份可能是氢氧化钙 | |
| D. | 《红楼梦》中有经典语句:女儿是水做的骨肉,男人是泥做的骨肉.水分子间通过氢键结合而质软,泥因其主要成分是碳酸钙而质硬.这句话借此形容男女的性格差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①④③ | B. | ②③④① | C. | ③④①② | D. | ①④③② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com