
【题目】下列电解质溶液中有关浓度关系不正确的是( )
A. 浓度均为0.1 mol/L的HF、KF混合溶液中:2c(H+)+c(HF)=2c(OH-)+c(F-)
B. 0.1 mol/L的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. 常温下,pH=5的NaHSO3溶液中,水电离出的c(H+)=1.0×10-9 mol/L
D. NH4+浓度均为0.1 mol/L的 ①NH4Cl、②NH4Al(SO4)2、③NH4HCO3三种溶液的浓度:③>①>②
【答案】B
【解析】
试题A.根据物料守恒可得2c(K+)= c(HF)+c(F-);根据电荷守恒可得c(K+)+ c(H+)= c(OH-)+c(F-)。将第二个式子变形可得c(K+)= c(OH-)+c(F-) -c(H+)。代入第一个式子。整理可得2c(H+)+c(HF)=2c(OH-)+c(F-)。正确。B.0.1 mol/L的Na2CO3溶液中:根据物料守恒可得c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3).错误。C.常温下,pH=5的NaHSO3溶液中,c(H+)=10-5mol/L,c(OH-)=10-14÷10-5=10-9mol/L.在水溶液中只有水电离产生OH-。所以 c(H+)(水)=c(OH-)=10-9mol/L。正确。D.三个溶液中都存在铵根离子的水解反应:NH4++H2O![]() NH3·H2O+H+。在②中还存在Al3++3H2O
NH3·H2O+H+。在②中还存在Al3++3H2O![]() Al(OH)3+3H+会对铵根离子水解起抑制作用。所以铵根离子浓度均为0.1 mol/L溶液的浓度①大于②的。在③中还存在HCO3-+H2O
Al(OH)3+3H+会对铵根离子水解起抑制作用。所以铵根离子浓度均为0.1 mol/L溶液的浓度①大于②的。在③中还存在HCO3-+H2O![]() H2CO3+OH-。对铵根离子的水解起促进作用,所以当铵根离子浓度相同时,溶液的浓度:③>①。因此物质是浓度的关系为③>①>②。正确。
H2CO3+OH-。对铵根离子的水解起促进作用,所以当铵根离子浓度相同时,溶液的浓度:③>①。因此物质是浓度的关系为③>①>②。正确。


科目:高中化学 来源: 题型:
【题目】下列是部分矿物资源铝土矿(主要含有氧化铝、氧化铁)和黄铜矿(主要成分CuFeS2)的利用及产品生产流程,有关说法不正确的是( )
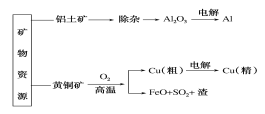
A. 除杂过程中铝元素的存在形式的变化可以如下:Al2O3→AlO2-→Al(OH)3→Al2O3
B. Al和Cu(精)均在电解槽的阴极获得
C. 粗铜炼制过程中反应2CuFeS2+O2![]() Cu2S+2FeS+SO2,每转移1.2mol电子,则有0.2mol硫被氧化
Cu2S+2FeS+SO2,每转移1.2mol电子,则有0.2mol硫被氧化
D. 若电解法分别制铝和铜的过程中转移电子数相等,理论上获得的铝和铜的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.标准状况下,2.24LCO2中所含分子数为0.1NA
B.常温常压下,14gCO和N2混合气所含原子总数为NA
C.在室温和常压下,72g36Cl2中含有36Cl原子的数目为2NA
D.18g重水D2O中所含质子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用如图所示仪器和药品先制取纯净干燥的氯气,再用氯气制备少量无水氯化铜(Cu+Cl2![]() CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。
CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。


(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接(____)接(____)接①接(____),其中②与④装置相连时,玻璃管接口(用装置中字母表示)应是____接____。
(2)③中仪器名称是___;装置④的作用是___;装置⑥的作用是____。
(3)实验开始时,应先检验装置的____,实验结束时,应先熄灭___处的酒精灯。
(4)在装置⑤的烧瓶中,发生反应的化学方程式为_____。
(5)若用含8 mol HCl的浓盐酸跟足量二氧化锰反应,产生氯气的物质的量应____(填“大于”、“等于”或“小于”)2 mol,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol CO和2 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生 反应:CO(g)+2H2(g)=CH3OH(g),ΔH=a kJ/mol,如图。下列分析中正确的是
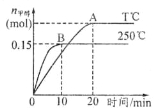
A.250°C时,010minH2 反应速率为 0.015 mol,/(L.min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容积体积,CO体积分数增大
D.a<0,平衡常数K:T0C时大于2500C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如下转化:下列相关离子方程式或化学方程式错误的是( )
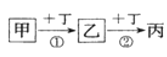
A. ①可能为CH4+Cl2![]() CH3Cl+HClB. ①可能为Fe+2Fe3+=3Fe2+
CH3Cl+HClB. ①可能为Fe+2Fe3+=3Fe2+
C. ②可能为2NO+O2=2NO2D. ②可能为CO32-+H2O+CO2=2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe3+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是
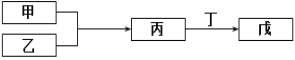
A. 若甲为单质,乙为O2,且甲可以与NaOH溶液反应放出H2,则丙不一定是两性氧化物
B. 若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊可能是氧化还原反应
C. 若甲为硫磺燃烧产物,丁为水,则戊的浓溶液不可用于干燥甲
D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com