
【题目】将8.985g 含少量氯化钠的碳酸氢钠固体加热一段时间,再加入足量盐酸完全反应。有关叙述正确的是
A. 固体分解越完全,消耗盐酸的量越少
B. 共生成0.1mol二氧化碳,固体中氯化钠为5.85g
C. 固体中碳酸氢钠含量越多,钠元素的含量也越多
D. 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g
科目:高中化学 来源: 题型:
【题目】如图为实验制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )

A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇和冰醋酸
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.试管b中饱和Na2CO3溶液可吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是( )
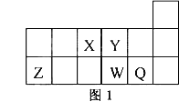
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 聚氯乙烯分子中含碳碳双键 B. 乙醇、苯和溴苯用水即可鉴别
C. 汽油、柴油、植物油都是碳氢化合物 D. 油脂的皂化反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:

①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,2H2(g)+ O2(g) ![]() 2H2O(l)+ 566kJ。下列说法错误的是
2H2O(l)+ 566kJ。下列说法错误的是
A. H2→H+H的过程需要吸收热量
B. 若生成2mol水蒸气,则放出的能量大于566 kJ
C. 2g氢气完全燃烧生成液态水所释放的能量为283kJ
D. 2mol氢气与1mol氧气的能量之和大于2mol液态水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三气体种物质的物质的量随时间的变化曲线如图所示,据此回答:

(1)该反应的化学方程式为___________
(2)从开始至2min,X的平均反应速率为________mol/(L·min)
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量 C.增加物质Z的物质的量. D.减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是理想的清洁能源。科学家通过化学方法使能量按人们所期望的形式转化,从而提高能源的利用率。
(1)氢气在燃烧时,放出大量热量,说明该反应是____反应(填“放热”或“吸热”);这是由于反应物的总能量___生成物的总能量(填“大于”或“小于”);从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量________形成产物的化学键放出的总能量(填“大于”或“小于”)。
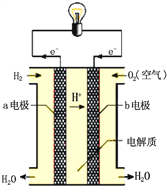
(2)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,右图就是能够实现该转化的装置,被称为氢氧燃料电池。
该电池的正极是_____(填“a电极”或“b电极”),在负极发生的电极反应式是_________________。电池反应的总方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com