
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 石灰石分解反应 | ||
| C. | NaOH溶液与盐酸反应 | D. | 甲烷与O2的反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
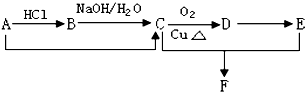
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①② | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
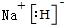 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
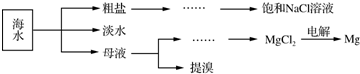
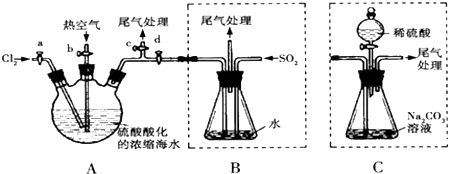
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl和37Cl的原子结构示意图相同 | |
| B. | 元素H只有11H和21H两种核素 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 1mol HCl分子和1mol HF分子断键需要的能量前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
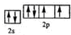 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com