
(13分)利用铜萃取剂M,通过如下反应实现铜离子的富集:
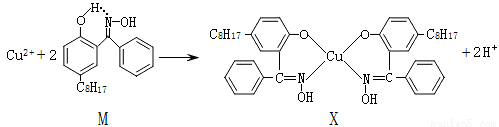
(1)X难溶于水、易溶于有机溶剂,其晶体类型为 。
(2)M所含元素的电负性由大到小顺序为 ,N原子以 轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有 (填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
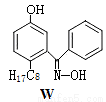
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是 。
(5)基态Cu2+的外围电子排布式为 ,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是 。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(13分)
(1)分子晶体 1 分
(2)O>N>C>H 2分
sp2杂化 2分
(3)be 2分
(4)M能形成分子内氢键,使溶解度减小 2分
(5)3d9 2分
3d轨道上没有未成对电子(3d轨道上电子为全空或全满)
【解析】
试题分析:(1)X难溶于水、易溶于有机溶剂,根据相似相溶性,有机物大都属于分子晶体,所以X属于分子晶体;
(2)M中含有C、N、O、H四种元素,同周期元素的电负性随核电荷数的增多而增强,H元素的电负性最弱,所以四种元素的电负性的强弱关系是O>N>C>H;X中N原子周围形成1个单键和1个双键,还有1对孤对电子,所以N原子乙sp2杂化轨道与O原子形成σ键;
(3)上述反应中,酚羟基的O-H键断裂,铜离子与N、O原子形成配位键,所以断裂和生成的化学键有共价键、配位键,答案选be;
(4)由题目可知,M分子中的氨基与酚羟基可形成分子内氢键,使溶解度减小;
(5)Cu原子的核外有29个电子,失去1个电子生成Cu+,所以Cu+外围电子排布式为3d9;Cu2+有颜色,3d轨道上有2个未成对电子,而Sc3+、Zn2+的3d轨道上没有未成对电子,为无色离子。
考点:考查物质的结构与性质的应用
考点分析: 考点1:物质的结构与性质 考点2:晶体结构与性质 考点3:元素周期律与元素周期表 试题属性

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:2014-2015学年浙江省六校高三3月联考理综化学试卷(解析版) 题型:填空题
(16分)CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍。具体反应为:
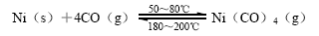
该正反应的ΔH 0(选填“>”或“=”或“<”)。
(2)工业上可利用CO生产乙醇:2CO(g)+4H2(g)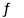 CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g) ΔH2
CO(g)+H2O(g)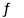 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g) 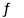 CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(3)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)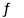 CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有___ 。
A.2v(H2)= v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+ 2H2(g)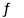 CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图28题-1)所示。
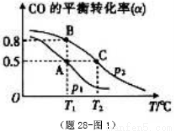
①合成甲醇的反应为__ __(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为__ __L。
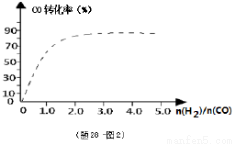
④(题28-图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图.当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.
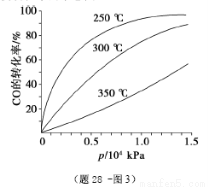
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(题28 -图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
-C3H7和-C3H7O取代苯环上的氢原子,形成的有机物中能与金属钠反应的同分异构体有
A.10种 B.15种 C.30种 D.36种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分散系中分散质粒子的大小:Fe (OH)3悬浊液<Fe (OH)3胶体<FeCl3溶液
B.可利用反应2CO=2C+O2(此反应 H>O、
H>O、 S<0)来消除CO污染
S<0)来消除CO污染
C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB
D.除去Cu粉中混有的CuO,可加入稀硝酸中,充分反应后过滤、洗涤、干燥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酸、碱、盐都是电解质 B.电解质都是易溶于水的物质
C.氧化物都是电解质 D.氢化物都不是电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月月考理综化学试卷(解析版) 题型:选择题
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。以下说法不正确的是
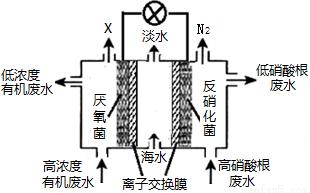
A.中间室Cl—移向左室
B.X气体为CO2
C.处理后的含硝酸根废水pH降低
D.电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:填空题
[化学一物质结构与性质)(13分)
I.镁条在空气中燃烧主要发生以下三个反应:
2Mg+O2 2MgO 3Mg+N2
2MgO 3Mg+N2 2Mg3N2 2Mg+CO2
2Mg3N2 2Mg+CO2 2MgO+C
2MgO+C
(1)基态氮原子核外电子的轨道表示式为 .
(2)上述三个反应中所涉及的非金属元素.的第一电离能由大到小的顺序为 。
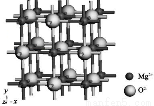
(3)MgO的晶体结构模型如图所示,若MgO晶体密度为ρg/cm3,图示中O2-与O2-的核间距a= .
Ⅱ.Mg3N2溶于水发生反应:Mg3N2+8H2O=3Mg(OH)2↓+2NH3·H2O
(4)氨水中各种微粒间不涉及的作用力是 (填选项序号)。
A.离子键
B.共价键
C.配位键
D.金属键
E.氢键
F.范德华力
(5)在一定条件下将NH气与CO2混合可制得尿素[CO(NH2)2],尿素分子中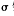 键的数目为 。
键的数目为 。
(6)向硫酸铜溶液中逐渐通入过量氨气,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。关于该晶体下列说法中正确的是 。
A.加入乙醇的目的是降低溶剂的极性,促使[Cn(NH3)4]SO4晶体析出
B.该配合物晶体中,N是配位原子,NH3为三角锥型,配位数是4
C.配离子内N原子排列成为平面正方形,可见Cu2+是sp3杂化
D.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
实验:①0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液等体积混合得到浊液,过滤。
②分别取少量①的滤液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清。
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解。
下列分析不正确的是
A.实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl
B.实验②证明了该温度下Ag2S比Ag2SO4更难溶解
C.实验③的溶液中含有Ag(NH3)2+微粒
D.由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:选择题
下述实验方案不能达到实验目的的是
编号 | A | B | C | D |
实验 方案 |
|
|
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
2mL0.1mol·L-1NaCl溶液 ① 加入3滴同浓度的AgNO3溶液再加入3滴同浓度的Na2S溶液 |
目的 | 验证乙炔的还原性 | 收集氨气 | 验证Fe电极被保护 | 验证AgCl的溶解度 大于Ag2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com