
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
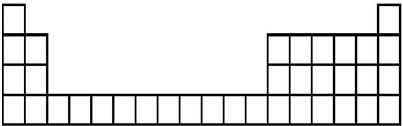
分析 短周期元素中,C、E都有-2价,处于ⅥA族,C有+6价且原子半径C>E,故C为硫、E为氧;D有-1价,原子半径大于氧,故D为Cl;A、B化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径A>B>硫,故A为Mg、B为Al,据此解答.
解答 解:短周期元素中,C、E都有-2价,处于ⅥA族,C有+6价且原子半径C>E,故C为硫、E为氧;D有-1价,原子半径大于氧,故D为Cl;A、B化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径A>B>硫,故A为Mg、B为Al.
(1)上述元素在周期表位置: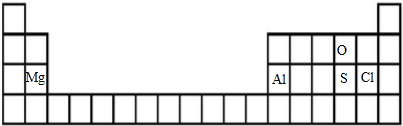 ,
,
故答案为: ;
;
(2)B为Al,元素处于周期表中第三周期第ⅢA族,故答案为:三;ⅢA;
(3)电子层结构相同,核电荷数越大离子半径越小,故离子半径:S2->Cl-,故答案为:S2->Cl-;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4,故答案为:HClO4;
(5)C、E形成的化合物为SO2、SO3,故答案为:SO2、SO3.
点评 本题考查结构性质位置关系综合应用,根据原子半径与化合价推断元素是解题关键,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
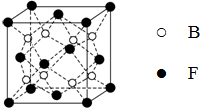 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.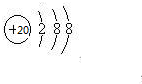 ,X的化学式Na3AlF6.
,X的化学式Na3AlF6.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| B. | 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面矿物油 | |
| C. | 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 | |
| D. | 钾(K)一般不用电解法制备,工业上可用Na与熔融KCl反应制K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
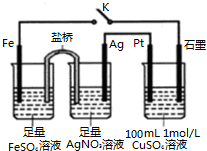
| A. | 盐桥中的电解质不可以用KCl | |
| B. | 闭合K,Pt电极上发生的反应为:4OH--4e-═O2↑+2H2O | |
| C. | 导线中流过0.5mol e-时,加入12.4g CuCO3,CuSO4溶液可恢复原组成 | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水:Al3++3H2O?Al(OH)3↓+3H+ | |
| B. | 氯化铵溶于水:NH4++H2O?NH3•H2O+H+ | |
| C. | 亚硫酸溶液中:H2SO3?2H++SO32- | |
| D. | 在小苏打溶液中滴加氢氧化钠:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液不产生沉淀,再加入硝酸银溶液,有不溶于稀硝酸的白色沉淀生成,可判定含有Cl- | |
| B. | 先加稀盐酸酸化,无沉淀生成,再加BaCl2溶液,产生白色沉淀,可判定含有SO42- | |
| C. | 加入NaOH溶液,有白色沉淀产生,可判定含有Mg2+ | |
| D. | 加入盐酸后有无色、无味气体逸出,此气体能使澄清石灰水变浑浊,可判定含有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com