
| A. | H2SiO3 | B. | HClO4 | C. | H2SO4 | D. | H2CO3 |
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | C4H10O的同分异构体有很多种,其中属于醇类只有5种 | |
| B. | 水解得到的两种物质,C2H4O2可以与金属钠作用放出氢气,而C4H10O不可以 | |
| C. | 该同学分离出的酯的化学式可表示为C6H12O2 | |
| D. | 水解得到的物质C2H4O2和甲醛的最简式相同,所以二者的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
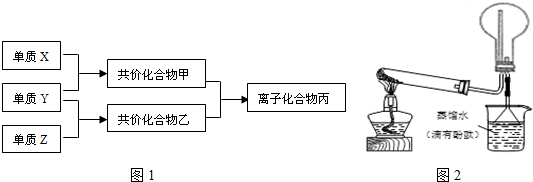
 ;甲的电子式:
;甲的电子式: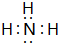 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:SiO2>NaCl>CO2 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 金属性:Na<Mg<Al | D. | 酸性强弱:H2SiO3<H2CO3<HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
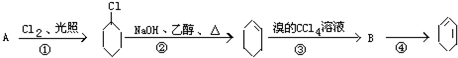
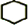 ,B的结构简式是
,B的结构简式是 .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$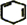 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入H2S溶液中 | B. | Cl2通入NaOH溶液 | ||
| C. | SO2通入KOH溶液中 | D. | H2S通入溴水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 除去乙烷气体中少量的乙烯:可将气体通过盛有酸性KMnO4溶液的洗气瓶 | |
| C. | 将等体积的苯、汽油和水在试管中充分振荡后静置,现象为: | |
| D. | 可用灼烧的方法鉴别蛋白质和纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
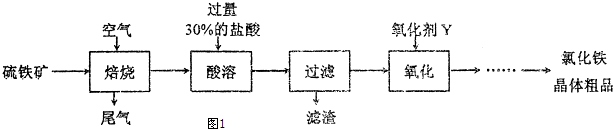
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com