
| A. | 容器中SO2、O2和SO3共存 | |
| B. | SO2和SO3的物质的量浓度相等 | |
| C. | 容器中SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | 反应器内压强不再随时间发生变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、可逆反应只要反应的发生就是反应物和生物共存的体系,故A错误;
B、两者浓度相等,而不是不变的状态,故B错误;
C、当体系达平衡状态时,SO2、O2、SO3的物质的量之比可能为2:1:2,也可能不是2:1:2,与各物质的初始量及转化率有关,故C错误;
D、反应器内压强不再随时间发生变化,说明物质的量不变,正逆反应速率相等,达平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向小苏打溶液滴加少量盐酸:HCO3-+H+═+H2O+CO2↑ | |
| B. | 用漂白液吸收过量SO2:SO2+H2O+ClO-=2H++SO42-+Cl- | |
| C. | 将少量乙烯气体通入酸性KMnO4溶液:CH2=CH2+4H++MnO4-═C2O42-+Mn2++4H2O | |
| D. | 将铜丝插入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双原子单质分子中的共价键一定是非极性键 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
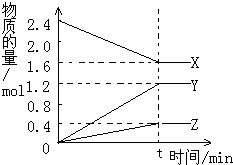 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都用铜容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;B的结构简式为:
;B的结构简式为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
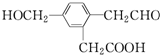 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )| A. | ②③④ | B. | ①③④⑤⑥ | C. | ①③④⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com