
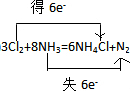
 ,故答案为:
,故答案为: ;
;| 2 |
| 3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:


 、
、 、
、 分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是
分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体颜色变深,平均相对分子质量不变 |
| B、平衡不移动,混合气体密度增大 |
| C、H2转化率增大,HI平衡浓度变小 |
D、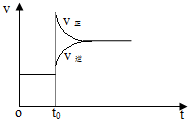 改变条件前后,速率图象为(如图) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H6和C3H8 |
| B、C2H6O和C2H4 |
| C、C5H8和C6H6 |
| D、C2H6和C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性 Rb>K>Mg>Al |
| B、非金属性 As>S>Cl>F |
| C、稳定性 AsH3>PH3>H2S>HF |
| D、半径 Na>P>O>F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com