
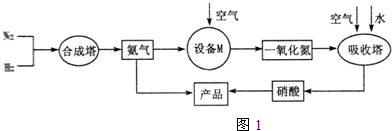
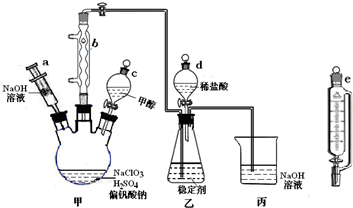
 、
、 、
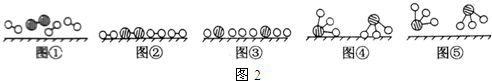
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.分析 (1)氨气在氧化炉中被催化氧化;氨气被氧化为NO和水;
(2)N2与H2合成NH3所用的催化剂是铁砂网;图②中两种双原子分子被吸附在催化剂表面;③中分子中的化学键断裂生成原子;
(3)合成氨的反应属于放热反应,热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,NO能被氧气氧化为二氧化氮;
(4)据反应化学方程式反应物和生成物的性质和经济效益分析,绿色化学为无污染,原子利用率高的生产;
(5)根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数.
解答 解:(1)氨气在氧化炉中被催化氧化,B设备的名称是;氨气被氧化为NO和水,其反应的方程式为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
故答案为:氧化炉;4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)N2与H2合成NH3所用的催化剂是铁砂网;图②中两种双原子分子被吸附在催化剂表面,即N2、H2被吸附在催化剂表面;③中分子中的化学键断裂生成原子,即在催化剂表面N2、H2中的化学键断裂生成N原子和H原子;
故答案为:铁砂网;N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂;
(3)合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
故答案为:利用余热,节约能源;使NO循环利用,全部转化为硝酸;
(4)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法,
故答案为:氨气还原法;
(5)由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为$\frac{1mol}{1mol+0.8832mol}$×100%=53%;即制HNO3所用去的NH3的质量占总耗NH3质量的53%,
故答案为:53.
点评 本题考查了工业制备原理应用,流程分析,实验制备物质的分析判断,利用物质的转化及质量守恒的方法来进行简单计算,使用硝酸铵的注意事项,明确转化中的化学反应得出物质之间的关系是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯的最高价为+7价而硫的最高价为+6价 | |
| B. | HCl的酸性比H2S的酸性强 | |
| C. | H2S能被Cl2氧化成硫单质 | |
| D. | HClO的氧化性比H2SO4的氧化性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 稳定剂 | 0天 | 2天 | 4天 | 6天 | 8天 | 10天 | 12天 | 14天 | 16天 |
| 稳定剂1浓度 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
| 稳定剂2浓度 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质的变性 | B. | 蛋白质的盐析 | C. | 胶体聚沉 | D. | 盐类水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 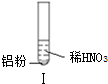 | 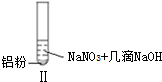 | 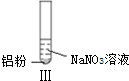 |
| 现象 | 溶液无色,试管上方 呈红棕色 | 产生大量气泡,能使湿润红 色石蕊试纸变蓝 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
| A. | 实验Ⅰ试管上方呈现红棕色的原因是:2NO+O2=2NO2 | |
| B. | 根据实验Ⅱ、Ⅲ的气体检验结果,说明都有NH3产生 | |
| C. | 实验Ⅰ溶液中发生的反应是:Al+6H++3NO3-=Al3++3NO2↑+3H2O | |
| D. | 在实验Ⅰ、Ⅱ、Ⅲ中,NO3-在酸、碱及中性溶液中都被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸除钢铁表面的铁锈利用了硫酸的酸性 | |
| B. | 干冰用于人工降雨,是利用了干冰升华吸热 | |
| C. | 胃药中含氢氧化镁是因为氢氧化镁能给人提供镁元素 | |
| D. | 碳酸氢钠作焙制糕点的发酵粉是利用了碳酸氢钠能与发醇面团中的酸性物质反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com