
����Ŀ������TiO2����ʮ�ֱ���Ĺ�ѧ���ʣ���������ҵ�����������ʾ�����õķ�չǰ������ͼ������������Ϊԭ���Ʊ����������ѵĹ�������ͼ��
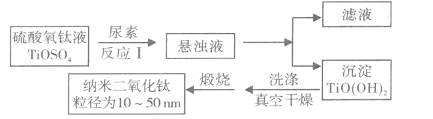
�ش��������⣺
��1����ӦI�з���������Ӧ����һ������[CO(NH2)2]��H2O��Ӧ����CO2��NH3��H2O������һ��Ӧ�����ӷ���ʽΪ____��
��2���ж�TiO(OH)2�����Ƿ�ϴ����ʵ������������ǣ�____��
��3��Ϊ�˼����Ʊ������е����������ŷţ������������е�����Һ������____��____��_____����������������ɻ���________���ѧʽ����
��4��Ϊ�о���Ӧ�¶ȡ���Ӧʱ�䡢��Ӧ�����ʵ�����ȵ����ض��Ʊ����������Ѳ��ʵ�Ӱ�졣�������ʵ�飺
ʵ���� | ��Ӧ�¶�/�� | ��Ӧʱ��/h | ��Ӧ�����ʵ������ |
�� | 90 | 1 | 2:1 |
�� | 90 | 2 | 3:1 |
�� | 90 | 1 | |
�� | 100 | 2 | 3:1 |
ʵ��ںܵ͢�ʵ��Ŀ����___��ʵ����з�Ӧ�����ʵ������Ϊ___����ӦI��TiO2+Ũ�ȶ�TiO2�IJ��ʺ�������Ӱ����ͼ��
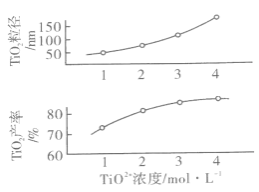
���ͼ����Ϣ������ΪΪ�ﵽ����Ŀ�ģ�����ʵ�TiO2+Ũ��Ϊ_______��
���𰸡�TiO2++2NH3��H2O= TiO(OH)2��+2NH4+ ȡ�������һ�ε�ϴ��Һ���Թ��У�������������ữ���ټ����Ȼ�����Һ�����ް�ɫ���dz��֣����������Ѿ�ϴ�Ӹɾ� ����Ũ�� ��ȴ�ᾧ ���� (NH4)2SO4 ̽����ͬ��Ӧ�¶ȶ��Ʊ�TiO2���ʵ�Ӱ�� 3:1 1mol/L
��������
����������Ϣ��֪����TiOSO4Ϊԭ�ϣ�������Ϊ�������Ʊ�����TiO2�ķ�Ӧԭ��Ϊ��
CO(NH2)2+3H2O=2NH3��H2O+CO2��
TiOSO4+2NH3��H2O=TiO(OH)2��+(NH4)2SO4
TiO(OH)2= TiO2+H2O
���TiOSO4�����ʺ�������������ͼ���з�����TiOSO4����ˮ������TiO2��������Һ��TiO2+��Ũ�ȣ�TiO2+�백ˮ��ϣ�����pH�����ɰ�ɫTiO(OH)2��������TiO(OH)2������ȫ����ˣ�����ȥ����ˮ���ϴ���������в��ټ��SO42-�����ˣ��»�һ��ʱ����������Ưϴ����պ�ɣ��ڲ�ͬ�¶������գ�����ĥ�����������Ʊ�������TiO2���ݴ˽��
��1��TiOSO4����ˮ������TiO2�������֪������Һ�к���TiO(OH)2�������һ��Ӧ�����ӷ���ʽΪ��TiO2++2NH3��H2O= TiO(OH)2��+2NH4+����Ϊ��TiO2++2NH3��H2O= TiO(OH)2��+2NH4+��
��2���ó������渽����SO42-���жϳ����Ƿ�ϴ�Ӹɾ����ɸ���ϴ��Һ���Ƿ���SO42-�������жϡ�ʵ�����������Ϊ��ȡ�������һ�ε�ϴ��Һ���Թ��У�������������ữ���ټ����Ȼ�����Һ�����ް�ɫ���dz��֣����������Ѿ�ϴ�Ӹɾ�����Ϊ��ȡ�������һ�ε�ϴ��Һ���Թ��У�������������ữ���ټ����Ȼ�����Һ�����ް�ɫ���dz��֣����������Ѿ�ϴ�Ӹɾ���
��3����Һ�к���һ������(NH4)2SO4����ͨ������Ũ������ȴ�ᾧ�����˽��л��գ���Ϊ������Ũ������ȴ�ᾧ�����ˣ�(NH4)2SO4��
��4���Աȱ������ݣ���֪ʵ��ںܵ͢ķ�Ӧ�����ʵ�����Ⱥͷ�Ӧʱ����ͬ����Ӧ�¶Ȳ�ͬ������Ϊ����ʵ�飬ʵ��Ŀ��Ϊ��̽����ͬ��Ӧ�¶ȶ��Ʊ�TiO2���ʵ�Ӱ�죻ʵ��ۺ�ʵ���Ϊ����ʵ�飬��ʵ��ۺ�ʵ��ٵķ�Ӧ�����ʵ������Ӧ��ͬ��ʵ��۵ķ�Ӧ�����ʵ������ӦΪ3:1�����ʵ��Ŀ��Ϊ̽����Ӧ�����ʵ�����ȶ��Ʊ�����TiO2���ʵ�Ӱ�죻�������Ϣ��֪����������������Ϊ10��50nm����������������TiO2+Ũ�ȹ�ϵͼ��TiO2+Ũ����������������Ҳ������TiO2+Ũ��Ϊ1mol/Lʱ��������������Ϊ50nm�������ʺϵ�TiO2+Ũ��Ϊ1mol/L����Ϊ��̽����ͬ��Ӧ�¶ȶ��Ʊ�TiO2���ʵ�Ӱ�죻3:1��1mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��Zn��CuΪ�缫��ϡH2SO4Ϊ�������Һ�γ�ԭ��ء�
��H2SO4������ѧ��Ϊ____________��
������0.4mole-�������ߣ��������ϸ�����������____________g��
������ϡ���ỻ������ͭ��Һ���缫�������ӵ���____________(�п������ͭ��������ԭ����____________(�õ缫����ʽ��ʾ����
(2)��T1�¶�ʱ�����ݻ�Ϊ2L�ĺ����ܱ������з�����Ӧ��2NO(g)+O2(g)![]() 2NO2(g)�������и���Ӧ�������������ʵ�����ʱ��仯��ͼ��ʾ���������жϴﵽ��ѧƽ�����____________
2NO2(g)�������и���Ӧ�������������ʵ�����ʱ��仯��ͼ��ʾ���������жϴﵽ��ѧƽ�����____________
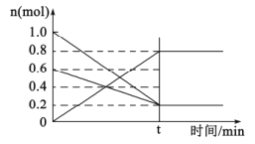
A����Ӧ��NO��O2�����ʵ���֮��Ϊ2��1
B��������������������ʱ��ı仯���仯
C����λʱ����ÿ����2nmolNO2��ͬʱ����nmolO2
D��2v��(O2)=v��(NO)
E����������ѹǿ����
��0~tʱ��Σ���Ӧ����v(NO2)=____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�ӽṹ��Ԫ�������ɵ�֪ʶ�������ƶ���ȷ����(����)
A.ͬ����Ԫ�غ������������˵���������Ӷ�����
B.��������Ų���ͬ������ѧ����Ҳ��ͬ
C.Cl����S2����Ca2����K���뾶��С
D.![]() Cl��
Cl��![]() Cl�õ���������ͬ
Cl�õ���������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��С��ͬѧ̽��ϡH2SO4����Һ�е�I����O2 ������Ӱ�����ء�
��1��Ϊ��̽��c(H+)�Է�Ӧ���ʵ�Ӱ�죬����ʵ�飺
10mL 1mol�� L��1 KI��Һ5�ε�����Һ | ��� | �����Լ� | ��ɫʱ�� |
�� | 10mL����ˮ | ��ʱ����ã�δ�����Ա仯 | |
�� | 10mL 0.1mol�� L��1H2SO4��Һ | ����3min����Һ���� | |
�� | 10mL 0.2mol�� L��1H2SO4��Һ | ����1min����Һ���� | |
�� | 10mL 0.1mol�� L��1K2SO4��Һ | ��ʱ����ã�δ�����Ա仯 |
�� д��ʵ�������Ӧ�����ӷ���ʽ ______��
�� ʵ���~�����ý��ۣ�_______��
�� ����ʵ���Ӧ���ʻ����Բ�ȡ�Ĵ�ʩ ______��
�� ʵ�����������______��
��2��Ϊ̽��c(H+)���˶Է�Ӧ����Ӱ���⣬�Ƿ�������Ӱ�죬������裺
��. ����c(H+)����ǿO2�������ԣ�
��. ����c(H+)��_______��
С��ͬѧ������ͼװ�����ʵ�鷽�����Լ��������֤��
| ��� | ��Һa | ��Һb | ���� |
�� | 10mL 1mol�� L��1 KI��Һ 10mL H2O | 10mL 0.1mol��L��1K2SO4��Һ 10mLH2O | ָ��δ��ƫת | |
�� | 10mL 1mol�� L��1 KI��Һ 10mL H2O | 10mL 0.1mol��L��1K2SO4��Һ 1mL 0.2mol��L��1H2SO4��Һ 9mL H2O | ָ�� ƫת | |
�� | X | 10mL 0.1mol��L��1K2SO4��Һ 10mL 0.2mol��L��1H2SO4��Һ | Y | |
�� | Z | 10mL 0.1mol��L��1K2SO4��Һ 10mLH2O | ָ��δ��ƫת |
ͨ��ʵ��֤ʵ���袡�����������пհ״����Լ�������������
X __________��Y _________��Z __________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��dz����������ζ���ϣ��״�����Ȳⶨ�������¡�
i. ��ȡ20.00 mL�״���Ʒ����100 mL����ƿ���Ƴɴ���Һ��
ii. ���ζ���ϴ������ϴ��װ����Һ���ϳ����촦���ݣ�����Һ����0�̶��ߡ�
iii. ȡ20.00 mL����Һ�ڽྻ����ƿ�У���3�η�̪��Һ����0.1000 mol�� L��1��NaOH��Һ�ζ����յ㣬��¼���ݡ�
iv. �ظ��ζ�ʵ��3�β���¼���ݡ�
��.�����������ȡ�
�ش��������⣺
��1��ʵ��i����ȡ20.00 mL�״����õ�������______������ĸ����
|
|
|
|
a | b | c | D |
��2����ʵ��ii�м�ʽ�ζ���δ��NaOH����Һ��ϴ������ɲⶨ�����ȷֵ_____������ƫ��������ƫС����������������
��3��ʵ��iii���жϵζ��յ��������_______��
��4��ʵ���������±�����ð״������Ϊ_______mol�� L��1��
����Һ���/mL | ��NaOH��Һ | ||
�ζ�ǰ����/mL | �ζ��յ����/mL | ||
��1�� | 20.00 | 0 | 21.98 |
��2�� | 20.00 | 0 | 22.00 |
��3�� | 20.00 | 0 | 22.02 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���о�������ˮ��ʴ��ʵ��װ�á�ͼ2��M��ij������Ƭ�����Ľ���������˵����ȷ����

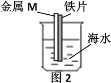
A.ͼ1��Ƭ�����ձ��ײ��IJ��֣���ʴ������
B.��M��пƬ���ɱ�����
C.��M��ͭƬ���ɱ�����
D.M��ͭ����п�����ܱ�����������û�й���ԭ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȸʯ����Ҫ�ɷ�ΪCu2(OH)2CO3���������������������������������ʵ�����Կ�ȸʯΪԭ���Ʊ�CuSO4��5H2O���������ͼ��
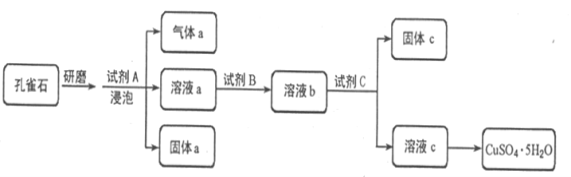
��1����ĥ��ȸʯ��Ŀ����________________________________________��
��2��ʹ���Լ�B��Ŀ���ǽ���Һ�е�Fe2��ת��ΪFe3�����Լ�B����ѡ��_______������ĸ����
A ����KMnO4��Һ B ˫��ˮ C Ũ���� D ������ˮ
��Ӧ�����ӷ���ʽ��______________��
��3��ʹ���Լ�C��Ŀ���ǵ�����Һ��pH��ʹFe3+ת��Ϊ�����Ա���룬�Լ�C��ѡ��__________������ĸ����A ϡ���� B NaOH��Һ C ��ˮ D CuO
��4��������Fe(OH)3��Ksp = 4��10-38����Ҫ����Һ�е�Fe3��ת��ΪFe(OH)3����������Һ��pH������4�����ʱc(Fe3��)=__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ���ڼӳɷ�Ӧ����
A.C6H12O6+6O2��6CO2+6H2O
B.CH2=CH2+HBr��CH3CH2Br
C.2CH3CH2OH+2Na��2CH3CH2ONa+H2��
D.![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͪ뿿��������ļ���Ͳⶨ����ṹʽ��ͼ��
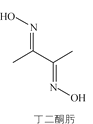
(1)NiԪ�ػ�̬ԭ�Ӽ۵����Ų�ʽΪ________��C��N��O��һ�������ɴ�С��˳����________��
(2)1mol����ͪ뿺��е�������Ŀ��________��̼ԭ�ӵ��ӻ���ʽΪ________��
(3)����ͪ��������ں��е���������________(����ĸ)��
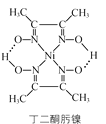
a.��λ������������b. ���Ӽ�����������c. �������������d. ���»���
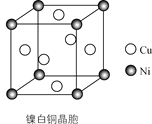
(4)ij����ͭ�ľ�����ͼ��ʾ���仯ѧʽΪ________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com