
下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
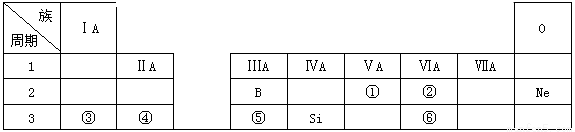
(1)①的元素符号是
(2)②和⑥两种元素的原子半径大小关系: (填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系: (填“>”或“<”);
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式: 。
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:实验题
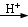
(14 分) 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应、装置图如下:
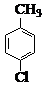
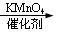
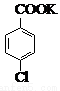 +MnO2
+MnO2 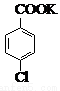
常温条件下的有关数据如下表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
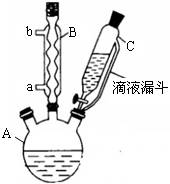
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g。
请回答下列问题:
(1)装置B的名称是 。
(2)量取6.00mL对氯甲苯应选用的仪器是 。(填选仪器序号)
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是 。对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是 。
(4)第一次过滤的目的是 ,滤液中加入稀硫酸酸化,可观察到的实验现象是 。
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是 。
(6)本实验的产率是 (填标号)。A.60% B.70% C.80% D.90%
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:填空题
己知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
N2(g)+3H2(g)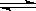 2NH3(g)△H=-92.60kJ/mol
2NH3(g)△H=-92.60kJ/mol

根据表中数据回答:
(1)反应进行到20min时放出的热量为__________kJ。
(2)0-10min内的平均反应速率v(N2)为__________mol/(L·min)
(3)此温度下该逆反应的化学平衡常数K(逆)=__________(保留两位小数).
(4)反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将__________(填“正向移动”或“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:填空题
一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
反应2:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应3:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图l所示。反应1、3的活化能如图2所示。

(1)则ΔH2________ΔH3(填“大于”、“小于”或“等于”),理由是________。
(2)反应1中ΔS1______0(填>、=或<=),指出有利于自发进行的温度条件____(填“较高温度”或:“较低温度”)
(3)将体积比为1:1的H2和CO2充入容积可变密闭容器内,若只进行反应1,下列措施中能使平衡时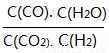 增大的是____________(填序号)
增大的是____________(填序号)
A.升高温度B.增大压强C.充入一定量的CO2 D.再加入一定量铁粉
(4)为了提高CO2和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是____________
(5)在温度为300℃时,使-定量合适体积比为的H2和CO2在体积恒定的密闭容器内进行反应。该温度下反应2进行程度很小可看成不进行,请在图3中画出CO、CH3OH浓度随时间变化至平衡的定性曲线图。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,m、n均为正整数,下列说法正确的是
A.离子半径:Rn+>Zm-
B.若Y的最高价氧化物对应的水化物HnYOm为强酸,则X的氢化物沸点一定比Y的氢化物的沸点低
C.若X的气态氢化物能使湿润的石蕊试纸变蓝,则标准状况下,18g Y的氢化物的体积为2.24 L
D.若R(OH)n为弱电解质,则W(OH)n+1可与KOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中文科化学试卷(解析版) 题型:选择题
将一小段镁带投入到盛有稀盐酸的试管中,发生剧烈反应。一段时间后,用手触摸试管外壁感觉烫手。这个实验事实说明该反应
A.为放热反应 B.为吸热反应
C.过程中热能转化为化学能 D.反应物的总能量低于生成物的总能量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中文科化学试卷(解析版) 题型:选择题
我国是一个淡水资源比较匮乏的国家,右图是海水淡化原理的一种示意图,符合此原理的方法称为
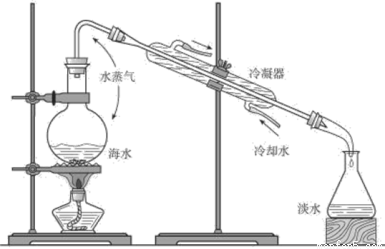
A.蒸馏法 B.电渗析法
C.离子交换法 D.太阳能蒸发法
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下期中化学试卷(解析版) 题型:选择题
已知三价铁离子的氧化性比铜离子强。现将amol铁和bmol铜的混合物与含有cmolHNO3的稀溶液充分反应,设还原产物为NO。下列结论:①若只有一种氧化产物,则3c=8a;②若只有二种氧化产物,被还原的硝酸物质的量为0.25c mol;③若有三种氧化产物,被还原的硝酸物质的量为0.25c mol;④若剩余金属0.5a mol,则氧化产物为一种或二种。其中正确的组合是
A.只有② B.①② C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
下列有关物质性质的说法错误的是
A.热稳定性:H2O>H2S B.原子半径:Na>Mg
C.酸性:H3PO4>H2SO4 D.还原性: I- >Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com