
| 组合 | 序号 | 计算式/mol?L-1 | ||||
| A | ①②③⑤ ①②③⑤ |
cB=
cB=
| ||||
| B | ②③⑤⑥ ②③⑤⑥ |
cB=
cB=
| ||||
| C | ①②⑤⑥ ①②⑤⑥ |
| ||||
| D | ②③④⑤ ②③④⑤ |
cB=
cB=
| ||||
| E | ①③④⑤ ①③④⑤ |
cB=
cB=
| ||||
| F | 不填 不填 |
不填 不填 |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| (m1-m2)g |
| Mg/mol |
| m1-m2 |
| M |
| n |
| V |
| ||
| V×10-3L |
| 1000(m1-m2) |
| MV |
| 1000(m1-m2) |
| MV |
| (ρV-m2)g |
| Mg/mol |
| ρV-m2 |
| M |
| n |
| V |
| ||
| V×10-3L |
| 1000(Vρ-m2) |
| MV |
| 1000(m1-m2) |
| MV |
| 1000(Vρ-m2) |
| MV |
| (m1-m2)g |
| Mg/mol |
| m1-m2 |
| M |
| m1g |
| ρg/mL |
| m1 |
| ρ |
| n |
| V |
| ||
|
| 1000ρ(m1-m2) |
| Mm1 |
| 1000ρ(m1-m2) |
| Mm1 |
| Sm2 |
| 100 |
| ||
| Mgmol/L |
| sm2 |
| 100M |
| n |
| V |
| ||
| V×10-3L |
| 10Sm2 |
| MV |
| 10Sm2 |
| MV |
| sm1 |
| s+100 |
| ||
| Mg/mol |
| sm1 |
| M(s+100) |
| n |
| V |
| ||
| V×10-3L |
| 1000m1S |
| MV(100+S) |
| 1000m1S |
| MV(100+S) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 135CV2 |
| V1 |
| 135CV2 |
| V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同温度下,CuS的溶解度大于ZnS的溶解度 | B、除去工业废水中的Cu2+,可以选用FeS做沉淀剂 | C、足量CuSO4溶解在0.1mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol/L | D、在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市六校高三12月联考化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60时反应制得。某学生拟有左下图所示的装置模拟制取并收集ClO2。
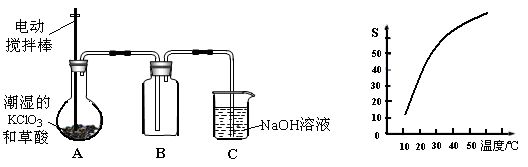
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B也必须添加温度控制装置,应该是 (选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
① ;② ;③洗涤;④干燥。
(4)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是 。
ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 →Na2S4O6 + 2NaI)
(5)判断滴定终点的现象 。原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com