
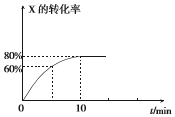
 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:分析 (1)根据浓度对反应速率的影响分析;
(2)根据v(Y)=$\frac{△c}{△t}$计算;
(3)利用三段式求出平衡时各物质的浓度,再根据K=$\frac{{c}^{2}(Z)}{{c}^{2}(X)×c(Y)}$计算;增大压强平衡向正方向移动;平衡常数只与温度有关;
(4)升高温度,平衡时X的转化率减小,则化学平衡逆向移动;
(5)采用极值法计算,假设X完全反应,根据方程式计算消耗的Y,再求出Y的转化率.
解答 解:(1)X是反应物,随着反应的进行,X的浓度减小,所以反应速率减小,则第2min时的反应速率v1(X)大于第8min时的反应速率可v2(X),
故答案为:大于;随反应进行,X的浓度逐渐减小;
(2)反应在0~10min内,X减少了1mol×80%=0.8mol,Y的物质的量变化为0.4mol,则v(Y)=$\frac{\frac{0.4mol}{10L}}{10min}$=0.004 mol•L-1•min-l;
故答案为:0.004;
(3)2X(g)+Y(g)?2Z(g),
起始物质的量(mol):1.0 0.8
转化物质的量(mol):0.8 0.4 0.8
平衡物质的量(mol):0.2 0.4 0.8
K=$\frac{{c}^{2}(Z)}{{c}^{2}(X)×c(Y)}$=$\frac{0.0{8}^{2}}{0.0{2}^{2}×0.04}$=400;
增大压强平衡向正方向移动,则X的转化率增大;平衡常数只与温度有关,温度不变,平衡常数不变;
故答案为:400;增大;不变;
(4)升高温度,平衡时X的转化率减小,则化学平衡逆向移动,升高温度平衡向吸热方向移动,所以逆方向为吸热方向,则正方向为放热,所以该反应的△H小于0;
故答案为:小于;
(5)采用极值法计算,假设X完全反应,则消耗1molX,由方程式2X(g)+Y(g)?2Z(g),可知消耗的Y为0.5mol,则Y的转化率为$\frac{0.5mol}{0.8mol}$×100%=62.5%,
由于X不能全部转化,所以Y的转化率一定小于62.5%;
故答案为:62.5%.
点评 本题考查化学平衡的有关计算、外界条件对化学平衡移动的影响,题目难度中等,注意根据三段式计算化学平衡常数,明确化学平衡常数的含义以及影响反应速率和化学平衡的因素是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2是氧化剂,NaOH是还原剂 | |
| B. | Br2既是氧化剂又是还原剂 | |
| C. | 被氧化的Br原子和被还原的Br原子的物质的量的比为5:1 | |
| D. | 每生成1mol的NaBrO3转移10mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 107:107:1:1 | B. | 1:10:107:107 | C. | 107:106:2:2 | D. | 107:106:2×107:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 使用资源节约型、环境友好型的生物降解塑料包装袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
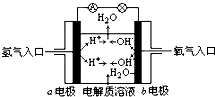
| A. | b电极是负极 | |
| B. | 总反应方程式为:2H2+O2═2H2O | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+F2═2HF | B. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+4NO2↑+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com