
| A. | 在0.2 mol•L-1的Na2CO3溶液中含有Na+的数目为0.4NA | |
| B. | 0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3 NA | |
| C. | 15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA | |
| D. | 标准状况下22.4 L CH4和C2H4的混合气体所含氢原子数为4NA |
分析 A、溶液体积不明确;
B、铁参与氧化还原反应后,可能变为+3价,还可能变为+2价;
C、求出过氧化钠的物质的量,然后根据过氧化钠和二氧化碳反应时,1mol过氧化钠转移1mol电子来分析;
D、求出混合气体的物质的量,然后根据甲烷和乙烯中均含4个H原子来分析.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法计算,故A错误;
B、铁参与氧化还原反应后,可能变为+3价,还可能变为+2价或+$\frac{8}{3}$价,故0.1mol铁反应后转移的电子数不一定为0.3NA个,故B错误;
C、15.6g过氧化钠的物质的量为0.2mol,而过氧化钠和二氧化碳反应时,1mol过氧化钠转移1mol电子,故0.2mol过氧化钠转移0.2NA个电子,故C错误;
D、标况下22.4L混合气体的物质的量为1mol,而甲烷和乙烯中均含4个H原子,故1mol混合气体中含4NA个H原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
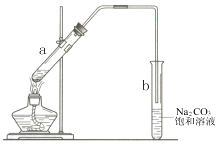
| A. | 向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出 | |
| D. | 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 | |
| B. | 用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol•L-1)通常需要用容量瓶等仪器 | |
| C. | 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4以防水解 | |
| D. | 用pH=1的盐酸配制100 mL pH=2的盐酸所需全部玻璃仪器有100 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的电负性大小顺序是Z<Y<X | |
| B. | WY2分子中σ键与π键的数目之比是2:1 | |
| C. | W、X、Y、Z的原子半径大小顺序是X>Y>Z>W | |
| D. | W、Z形成的分子的空间构型是三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| B. | 一定条件下用含1mol FeCl3的溶液制备Fe(OH)3胶体,产生NA个Fe(OH)3胶粒 | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | NaCl+AgNO3=AgCl↓+NaNO3 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | CaO+H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液c(Na + ):①>②>③ | |
| B. | 加热0.1mol/LNa2CO3溶液,CO3 2- 的水解程度和溶液的PH均增大 | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红,原因是:CO3 2-+H2O?HCO3-+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com