
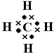 .
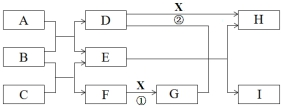
.分析 A、B、C、D、F均为气体,F是黄绿色单质,则F为Cl2,E是最常见的液体,E为H2O,气体A与气体B反应生成气体D与水,其中A的相对分子质量为16,则A为CH4、B为O2,X微溶于水,反应②常用于D的检验,可推知D为CO2,X为Ca(OH)2,氧气与气体C反应生成水与氯气,由元素守恒可知C为HCl,反应①是工业生产中的重要反应,二氧化碳、水与G反应得到碳酸钙乙I,则G为Ca(ClO)2,I为HClO,据此解答.
解答 解:A、B、C、D、F均为气体,F是黄绿色单质,则F为Cl2,E是最常见的液体,E为H2O,气体A与气体B反应生成气体D与水,其中A的相对分子质量为16,则A为CH4、B为O2,X微溶于水,反应②常用于D的检验,可推知D为CO2,X为Ca(OH)2,氧气与气体C反应生成水与氯气,由元素守恒可知C为HCl,反应①是工业生产中的重要反应,二氧化碳、水与G反应得到碳酸钙乙I,则G为Ca(ClO)2,I为HClO.
(1)A为CH4,电子式为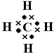 ,故答案为:
,故答案为: ;
;
(2)C的化学式为HCl,故答案为:HCl;
(3)反应①的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)反应②的离子方程式:Ca2++2OH-+CO2=CaCO3↓+H2O,故答案为:Ca2++2OH-+CO2=CaCO3↓+H2O.
点评 本题考查无机物推断,物质的颜色、状态为推断突破口,再结合题目信息与转化关系进行推断,结合的考查学生分析推理能力、元素化合物知识,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
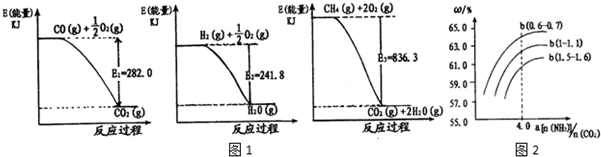
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是可逆反应 | |
| B. | 升高温度可以加快反应速率 | |
| C. | 使用催化剂可以加快反应速率 | |
| D. | 使用过量乙醇能使乙酸完全转化为乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的乙烯与乙醇充分燃烧时消耗氧气的质量相等 | |
| B. | 生活中用于制造水杯、奶瓶、食物保鲜膜等用品的聚氯乙烯是通过加聚反应得到的 | |
| C. | 分子式为C6H12的某链状有机物,6个碳原子肯定在同一平面上,则与氢气加成后产物的名称为2,3-二甲基丁烷 | |
| D. | 红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构分别如图所示: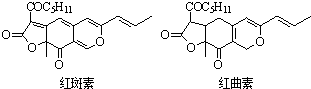 太阳能光触媒则红斑素和红曲素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、Cl-、S2-和SO42-可以大量共存 | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合,反应的离子方程式为:HSO3-+OH-=SO32-+H2O | |
| C. | NH4HSO3为弱酸弱碱盐,其水溶液pH>7 | |
| D. | c(NH4+)>c(HSO3-)>c(SO32-)>C(H2SO3)>C(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
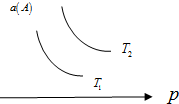 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )| A. | a+b<c | |
| B. | 若T2>T1,则该反应在高温下易自发进行 | |
| C. | △H>0 | |
| D. | 若T2<T1,则该反应一定不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若W为有颜色的物质,达平衡后,增大压强,体系颜色变浅 | |
| B. | 改变压强,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小 | |
| D. | 平衡时,其他条件不变,分离出 Z,正反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com