
电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.
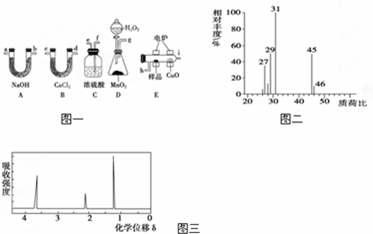
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是g→f→e→h→i→c(或 .
(2)C装置中浓硫酸的作用是 .
(3)D装置中MnO2的作用是 .
(4)燃烧管中CuO的作用是 ;.
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为
(6)用质谱仪测定其相对分子质量,得如图一所示的质谱图,则该有机物的相对分子质量为 .
(7)能否根据A的实验式确定A的分子式能(填“能”或“不能”),若能,则A的分子式是 能,则此空不填).
(8)该物质的核磁共振氢谱如图二所示,则其结构简式为CH3CH2OH.
考点: 有机物实验式和分子式的确定.
专题: 实验题.
分析: (1)根据实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳、B用来吸收水、C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(2)由(1)得D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥;
(3)由(1)得MnO2为分解制备氧气的催化剂;
(4)由(1)得一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知,CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(5)根据元素守恒法确定有机物的实验式;
(6)根据质谱图可知有机物的相对分子质量;
(7)要确定有机物的分子式,要知道有机物的相对分子质量和实验式;
(8)核磁共振氢谱中峰值数等于有机物中氢原子的种类数确定有机物的种类;
解答: 解:(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选择装置各导管的连接顺序是g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a).
故答案为:g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a).
(2)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果;
故答案为:吸收水分、干燥氧气;
(3)MnO2为分解制备氧气的催化剂;
故答案为:作催化剂、加快产生O2的速率;
(4)一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知,CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
故答案为:使有机物更充分氧化为CO2、H2O;
(5)A管质量增加1.76g说明生成了1.76g二氧化碳,可得碳元素的质量:1.76g×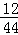 ×100%=0.48g,
×100%=0.48g,
B管质量增加1.08g说明生成了1.08g水,可得氢元素的质量:1.08g×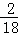 ×100%=0.12g,从而可推出含氧元素的质量为:0.92g﹣0.48g﹣0.12g=0.32g,
×100%=0.12g,从而可推出含氧元素的质量为:0.92g﹣0.48g﹣0.12g=0.32g,
设实验式为CXHYOZ,则X:Y:Z=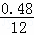 :
: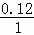 :
: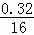 =2:6:1,即实验式为:C2H6O,
=2:6:1,即实验式为:C2H6O,
故答案为::C2H6O;
(6)质谱图可知有机物的相对分子质量为46,
故答案为:46;
(7)有机物的实验式为:C2H6O,所以分子式为(C2H6O)n,相对分子质量为46n,而有机物的相对分子质量为46,则n=1,所以分子式为C2H6O,
故答案为:能;C2H6O;
(8)核磁共振氢谱中给出3种峰,说明该分子中有3种H原子,所以其结构简式为:CH3CH2OH;
故答案为:CH3CH2OH;
点评: 本题考查有机物的分子式、结构简式的确定,题目难度中等,关键在于清楚实验的原理,掌握实验方法.


科目:高中化学 来源: 题型:
某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生:一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是()
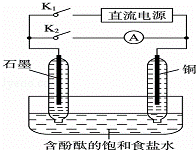
A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl﹣═Cl2↑+H2↑
B. 断开K1,闭合K2时,石墨电极作正极
C. 断开K2,闭合K1时,石墨电极附近溶液变红
D. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e﹣═2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某待测溶液(阳离子为Na+)中可能含有SO42﹣、SO32﹣、NO3﹣、C1﹣、Br﹣、S2﹣、CO32﹣、HCO3﹣中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题: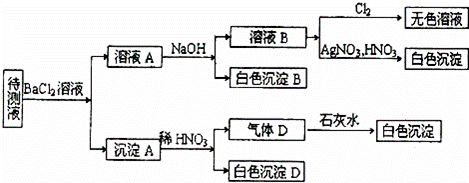
(1)待测液中是否含有SO42﹣、SO32﹣: .
(2)沉淀B的化学式为 ;生成沉淀B的离子方程式为 .
(3)根据以上实验,待测液中肯定没有的离子是 ;肯定存在的离子还有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是()
A. 等体积pH=3的酸溶液和pH=11的碱溶液相互混合后,溶液的pH一定等于7(25℃)
B. 固态磷酸是电解质,所以磷酸在熔化时或溶解于水时都能导电
C. 锌与pH=3的CH3COOH 溶液反应比pH=4 的盐酸反应剧烈
D. 在0.1 mol/L Na2CO3溶液中,2c(Na+)=c(H2CO3)+c(CO32﹣)+c(HCO3﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是()
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有S2﹣、HCO3﹣、CO32﹣、CH3COO﹣4种阴离子.若向其中加入足量Na2O2后,溶液中离子数目基本保持不变的是()
A. S2﹣ B. HCO3﹣ C. CO32﹣ D. CH3COO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应①KHCO3溶液与石灰水反应;②Na2CO3 溶液与稀盐酸反应;③Na与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量或浓度,不能用同一个离子方程式表示的是()
A. ①②③ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
铁单质及其化合物在生活、生产中应用广泛.请回答下列问题:
(1)由于氧化性Fe3+>Cu2+,氯化铁溶液常用做印刷电路铜板腐蚀剂,反应的离子方程式是 .
(2)硫酸铁可做絮凝剂,常用于净水,其原理是
(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是 .
(3)磁铁矿冶炼铁的原理是Fe3O4+4CO=3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移的电子的物质的量是 .
(4)表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
选项 陈述Ⅰ 陈述Ⅱ 判断
A 铁是地壳中含量最高的金属元素 铁是人类最早使用的金属材料 Ⅰ对;Ⅱ对;有
B 常温下铁与稀硫酸反应生成氢气 高温下氢气能还原氧化铁得到铁 Ⅰ对;Ⅱ对;无
C 铁属于过渡元素 铁和铁的某些化合物可用做催化剂 Ⅰ错;Ⅱ对;无
D 在空气中铁的表面能形成致密的氧化膜 铁不能与氧气反应 Ⅰ对;Ⅱ对;有
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既属于化合反应,又属于氧化还原反应的是( )
|
| A. | Fe+2HCl=FeCl2+H2↑ | B. | 2FeCl2+Cl2=2FeCl3 |
|
| C. | CaO+H2O=Ca(OH)2 | D. | 2Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com