
| A. | 已知电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11.H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-═SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S═PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O |
分析 A.依据电离常数判断酸性强弱,依据强酸制备弱酸规律解答;
B.控制pH为9~10,为碱性环境,离子方程式的反应物中不能存在氢离子;
C.硫酸铅能够溶于醋酸铵,说明反应生成了弱电解质醋酸铅,醋酸铅在离子方程式中不能拆开;
D.氢氧化铜能够与一水合氨反应生成[Cu(NH3)4]2+.
解答 解:A.电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11.,可知碳酸酸性强于亚硫酸氢根,依据强酸制备弱酸规律,H2SO3+2HCO3-═SO32-+2CO2↑+2H2O不能发生,故A错误;
B.控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体,正确的离子方程式为:2CN-+5ClO-+H2O=N2↑+2CO2↑+5Cl-+2OH-,故B错误;
C.硫酸铅可溶于醋酸铵溶液中,形成无色溶液,说明醋酸铅为弱电解质,醋酸铅不能拆开,正确的反应为:(CH3COO)2Pb+H2S=PbS↓+2CH3COOH,故C错误;
D.CuSO4溶液与过量浓氨水反应,反应的离子方程式为:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写判断,题目难度中等,试题知识点较多、题量较大,充分考查学生灵活应用基础知识的能力,注意熟练掌握离子共存的条件、离子方程式的书写原则.


科目:高中化学 来源: 题型:解答题
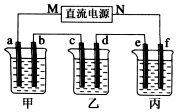 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过t mim后,测得甲中NaOH浓度为6.097%,乙中d电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
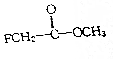 氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )
氟乙酸甲酚属于剧毒化工品,接触不慎有致命危险,氟乙酸甲酚的结构简式如图所示,下列说法不正确的是( )| A. | 它含有两种官能团 | B. | 它属于卤代烃 | ||
| C. | 它能发生水解反应 | D. | 它属于烃的衍生物. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.5 | FeS沉淀完全 | 5.5 |
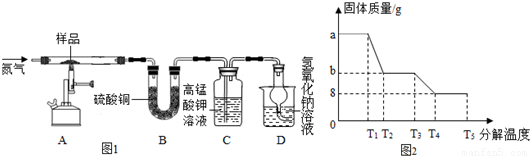
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键 | |
| B. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 | |
| C. | H、S、O三种元素组成的物质的水溶液与Na、S、O三种元素组成的物质的水溶液混合可能会观察到浑浊现象 | |
| D. | 测定中和热的实验中,应将酸、碱溶液一次性倒入量热装置中,并不断搅拌,待温度稳定后记下温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(NO3)3溶液中加人过量的HI溶液2Fe3++2I-═2Fe2++I2 | |
| C. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba-+2BaCO3↓+2HO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2165 kJ•mol-1 | B. | 2033 kJ•mol-1 | C. | 406.6 kJ•mol-1 | D. | 2077 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com