
【题目】25℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol/L的Ba(OH)2溶液③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
【答案】A
【解析】
25℃时,①pH=0的H2SO4溶液中c(H+)=1.00 mol/L,水电离出的c(OH-)=c(H+)=![]() =
=![]() mol/L=10-14 mol/L;
mol/L=10-14 mol/L;
②0.05 mol/L的Ba(OH)2溶液中c(OH-)=2c[Ba(OH)2]=2×0.05 mol/L=0.1 mol/L,水电离出的c(H+)=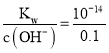 mol/L=10-13 mol/L;
mol/L=10-13 mol/L;
③pH=10的Na2S溶液中水电离出的c(H+)= c(OH-)=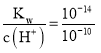 mol/L=10-4 mol/L;
mol/L=10-4 mol/L;
④pH=5的NH4NO3溶液中水电离出的c(H+)=10-5 mol/L;
则在等体积的①pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,则由水电离产生的H+浓度之比=10-14 mol/L:10-13 mol/L:10-4 mol/L:10-5 mol/L=1:10:1010:109,故合理选项是A。


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下有可逆反应:A(g)+2B(g)![]() 2C(g)+D(g)。现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是
2C(g)+D(g)。现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是
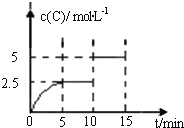
A.在0~5min内,正反应速率逐渐增大
B.反应从起始至5min时,B的转化率为50%
C.5min时的平衡常数与10min时的平衡常数不等
D.第15min时,B的体积分数为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量。

【1】实验前需进行的操作是: _______,稀盐酸中加入少量FeCl3溶液的作用是:_________。
【2】用恒压分液漏斗的优点有:
① ___________;
② 使分液漏斗内液体顺利滴下。
实验结束时,待恢复至室温,先_______,再平视刻度线读数。
实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
【3】推算该样品中过氧化镁的质量分数_______ (用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.5 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
【4】该实验在滴定前需加入少量______作指示剂;判断到达滴定终点的现象是_____;推算该样品中过氧化镁的质量分数为____(保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.pH=1的溶液中:HCO3﹣、NH4+、NO3﹣、Ca2+
B.在强碱性溶液中:Na+、K+、AlO 2﹣、Cl﹣
C.无色溶液中:Fe3+、MnO4﹣、Cl﹣、H+
D.由水电离的c(H+)=1.0×10﹣12 molL﹣1的溶液中:ClO﹣、Na+、![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
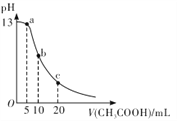
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)__、__、__
(2)通过计算,填写下表:
c(H+) | c(SO42﹣) | c(Fe2+、Fe3+) |
__ | __ | __ |
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 盐酸普罗帕酮是一种高效速效抗心律失常药。合成此药的原料D的流程如下:
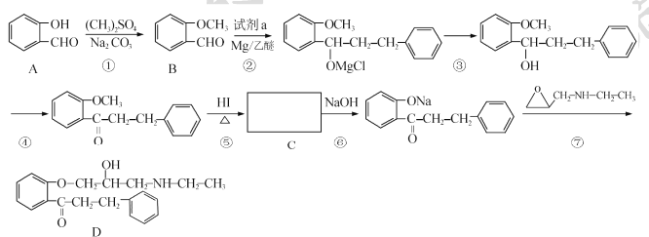
已知: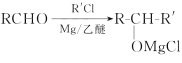
请回答以下问题:
(I)A的化学名称为____,试剂a的结构简式为____。
(2)C的官能团名称为____________。
(3)反应⑤的反应类型为____;反应①和⑤的目的为_______。
(4)满足下列条件的B的同分异构体还有 ___种(不包含B)。其中某同分异构体x能发生水解反应,核磁共振氢谱有4组峰且峰面积比为3:2:2:1,请写出x与NaOH溶液加热反应的化学方程式____。
①能发生银镜反应 ②苯环上有2个取代基
(5)关于物质D的说法,不正确的是____(填标号)。
a.属于芳香族化合物
b.易溶于水
c.有三种官能团
d.可发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1己二酸(简写为H2A,电离常数分别为Ka1、Ka2)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是
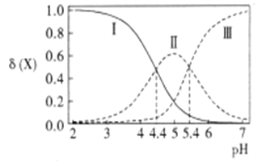
A.Ka1=10-4.4
B.曲线II表示的是HA-的物质的最分数δ(X)肋pH的变化关系
C.NaHA溶液中:c(H+)=c(OH-)+2c(A2-)-c(H2A)
D.等物质的量浓度的Na2A与NaHA混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com