
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷(解析版) 题型:填空题
氰化钠(NaCN)是重要的化工原料,常用于化学合成、冶金工业等。回答下列问题:
(1)下列标志中,应贴在装有氰化钠容器上的是 。

(2)写出NaCN的电子式 。
(3)可用纯碱、焦炭、氨气反应制取NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目 。
(4)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[ Au(CN)2]生成金。“浸取”反应的氧化剂是 ,消耗的锌与生成的金的物质的量之比为 。
(5)工业利用NaCN制备蓝色染料的流程如下:
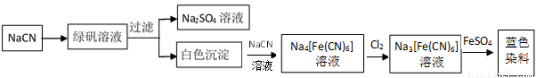
通入Cl2时发生反应的离子方程式为_ _,该蓝色染料的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:实验题
某溶液的溶质离子可能含有Mg2+、Ba2+、CO32-、Cl-、SO42-、NO3-中的几种,现进行如下实验:
1.取适量溶液,加入足量NaOH溶液,生成白色沉淀;
2.过滤,向实验1所得的滤液中加入足量H2SO4溶液,有白色沉淀生成。根据上述实验回答下列问题。
(1)溶液中一定不存在的离子是
(2)写出1和2中所发生反应的离子方程式
(3)为了验证溶液中是否存在Cl-、NO3- ,某同学提出下列假设:
①只存在Cl- ;②Cl-、NO3-同时存在;③ 。
已知实验提供的试剂只有稀盐酸、AgNO3溶液、稀硝酸、NaOH溶液和蒸馏水。
实验方法:
实验 现象:
现象:
实验结论:假设③正确
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:选择题
一定量的KClO3中加入浓盐酸:KClO3 +6HCl(浓盐酸)= KCl +3Cl2 ↑+3H2O,其中发生氧化反应的元素和发生还原反应的元素的质量之比是( )
A.1 :6 B.6 :1 C.1 :5 D.5 :1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上半期考试化学卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓[
B.稀硫酸与铁粉反应:2Fe+6H+= 2Fe3++3H2↑
2Fe3++3H2↑
C.盐酸与氢氧化钠溶液 反应:H++OH-=H2O
反应:H++OH-=H2O
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高一上期中化学卷(解析版) 题型:填空题
某一反应体系中反应物和生成物共有六种物质:HC1(浓)、KMnO4、MnCl2、H2O、Cl2、KCl。已知Cl2、MnCl2为生成物。
(1) 该反应中的氧化剂为____________,氧化产物为________。氧化产物与还原产物的物质的量之比为___________。
(2) 若产生的气体在标准状况下的体积为1.12 L,则反应过程中转移的电子数为_________NA(NA表示阿伏加德罗常数的数值)。
(3) 若反应中转移0.3 mol电子,则消耗(或生成)HC1____________g。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高一上期中化学卷(解析版) 题型:选择题
不能用离子方程式H++OH-=H2O表示的反应是
A.盐酸与氢氧化钾溶液反应 B.硫酸与氢氧化钡溶液反应
C.硝酸与氢氧化钠溶液反应 D.盐酸与澄清石灰水反应
查看答案和解析>>
科目:高中化学 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
周期表中16号元素和4号元素的原子相比较,前者的下列数是后者的4倍的是
A. 质子数 B. 最外层电子数 C. 电子层数 D. 内层电子数
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上月考四化学卷(解析版) 题型:简答题
氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法,完成下列问题:
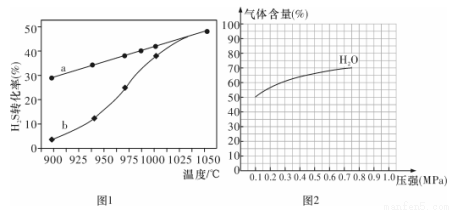
(1)方法一:H2S热分解法,反应式为:2H2S(g) 2H2(g) + S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
2H2(g) + S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H ______0(填“>”“<”或“=”)。
②若985 ℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=________(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因: _______________。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I.C(s)+H2O(g)==CO(g)+H2(g)△H=+131.6kJ/mol
II.CO(g)+H2O(g)==CO2(g)+H2(g)△H=-43kJ/mol
III.CaO(s)+CO2(g)==CaCO3(s)△H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)==CaCO3(s)+2H2(g)的△H =________(保留到小数点后面1位);若K1、K2、K3分别为反应I、II、III的平衡常数,该反应的平衡常数k=_________(用K1、K2、K3表示)。
② 对于可逆反应 C(s)+2H2O(g)+CaO(s) CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是___________。(填字母编号)
CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是___________。(填字母编号)
A.适当的降低体系的温度 B.压缩容器的体积
C.用特殊材料吸收氢气 D.增加CaO的量
③ 图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c( H2O) = 2c(H2)= 2c(CO) = 2 mol/L,试根据H2O的体积百分含量变化曲线,补充完整 CO的变化曲线示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com