
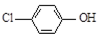
 ),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )
),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )
| A. | 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1 NA | |
| B. | A极的电极反应式为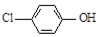 +e-=Cl-+ +e-=Cl-+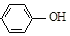 | |
| C. | 铁电极应与Y相连接 | |
| D. | 反应过程中甲中右边区域溶液pH逐渐升高 |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为H++ +2e-=Cl-+
+2e-=Cl-+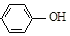 ,电流从正极经导线流向负极,据此分析.
,电流从正极经导线流向负极,据此分析.
解答 解:A、据电荷守恒,当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA,故A错误;
B、A为正极,正极有氢离子参与反应,电极反应式为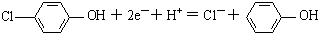 ,故B错误;
,故B错误;
C、镀件铁是阴极,与电源的负极相连,即与Y相连接,故C正确;
D、甲中右边是负极发生氧化反应,电极反应式为:CH3COO--8e-+4H2O=2HCO3-+9H+,所以溶液的PH值减小,故D错误;
故选C.
点评 本题考查了原电池原理以及电镀原理,为高频考点,侧重于学生的分析、计算能力的考查,明确原电池正负极上得失电子、电解质溶液中阴阳离子移动方向即可解答,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式 C2H4O2 | B. | 氯化钠的电子式: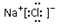 | ||
| C. | 硫原子的原子结构示意图: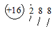 | D. | 水的电离方程式 2H2O═H3O++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都能发生水解反应 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 苯不能使溴的四氯化碳溶液褪色,但能与H2发生加成反应 | |
| D. | 因分子中均含有官能团“-OH”,故乙醇、乙酸水溶液均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向海水中加入净水剂明矾可以使海水淡化 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 海水淡化的方法主要有电渗析法、蒸馏法、离子交换法等 | |
| D. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键 | |
| B. | 水分子是一种极性分子,水分子空间结构呈直线型 | |
| C. | 冰与干冰都是分子晶体,其晶胞中分子的空间排列方式类似 | |
| D. | 水分子间通过H-O键形成冰晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
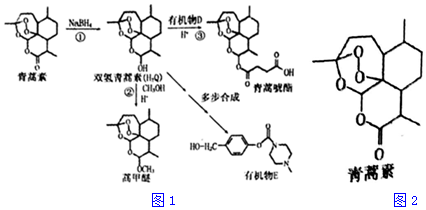
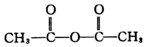 +H-OH→
+H-OH→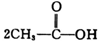
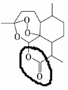 ;根据酯的性质判断青蒿素可能具有的某种化学性质和反应条件为可在酸性或碱性条件下发生水解反应.屠呦呦教授率领的研究团队先后经历了用水、乙醇、乙醚提取青蒿素的探究过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素;研究发现这是因为青蒿素分子中的某个基团在提取过程中对热不稳定,试写出该基团的结构式-O-O-.
;根据酯的性质判断青蒿素可能具有的某种化学性质和反应条件为可在酸性或碱性条件下发生水解反应.屠呦呦教授率领的研究团队先后经历了用水、乙醇、乙醚提取青蒿素的探究过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素;研究发现这是因为青蒿素分子中的某个基团在提取过程中对热不稳定,试写出该基团的结构式-O-O-.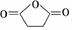 .
.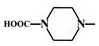 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式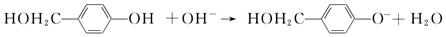 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、M的离子半径为M<W | |
| B. | YZ2为直线形的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Z与X形成的化合物的熔沸点偏高是因其分子内存在氢键 | |
| D. | Z与M形成的化合物可作为耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com