
【题目】NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,用离子方程式表示原因_____________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的作用是_________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。向饱和NaClO溶液中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是_______________________。
(4)常温下,pH=11的NaClO溶液中,水电离出来的c(OH-)=________,在pH=3的HClO溶液中,水电离出来的c(H+)=____________________________。
(5)已知纯水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(6)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
(7) 在25 ℃时,将0.2 mol NaA晶体和0.1 mol HA气体同时溶解于同一烧杯的水中,制得1 L溶液,则c(HA)+c(A-)= mol·L-1
【答案】(1)ClO-+H2O![]() HClO+OH-(2)漂白
HClO+OH-(2)漂白
(3)Al3++3ClO-+3H2O=3HClO+Al(OH)3↓
(4)10-3mol·L-1;10-11mol·L-1
(5)D(6)<(7)0.3mol·L-1
【解析】
试题分析:(1)NaClO为强碱弱酸盐,水解呈碱性,离子方程式为ClO-+H2O![]() HClO+OH-;
HClO+OH-;
(2)NaClO具有强氧化性,可用于漂白;
(3)向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀,Al3+与ClO-发生互促水解反应,离子方程式为Al3++3ClO-+3H2O═3HClO+Al(OH)3↓;
(4)NaClO为强碱弱酸盐,pH=11的NaClO溶液中,c(OH-)=10-3mol/L,c(H+)=10-11mol/L,NaClO中氢离子和氢氧根离子都是水电离的,则水电离出来的c(OH-)为10-3mol/L;在pH=3的HClO溶液中,c(OH-)=10-11mol/L,酸中的氢氧根离子由水电离,则水电离出来的c(OH-)=c(H+)为10-11mol/L;
(5)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;B.向水中加Na2CO3固体,水解呈碱性,故B错误;C.加热至100℃,促进水的电离,溶液呈中性,故C错误;D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;故答案为D;
(6)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水;
(7)将0.2 mol NaA晶体和0.1 mol HA气体同时溶解于同一烧杯的水中,根据物料守恒可知n(HA)+n(A-)=0.3mol,则c(HA)+c(A-)=0.3mol÷1L=0.3mol·L-1。


科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g) ![]() 2AB2(g)△H<0,下列说法正确的是( )
2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学------选修3:物质结构与性质]
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,
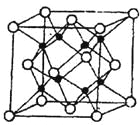
则图中黑球代表的离子是_________(填离子符号),该离子的配位数为 。该晶胞参数a="b=c=d" pm ,列式计算R2M晶体的密度为 g/cm。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.木材纤维和土豆淀粉遇碘水均显蓝色
B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.PX项目的主要产品对二甲苯属于饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH![]() CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O![]() CH3COOH+OH- K2=5.71×10-10 △H2>0
CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是( )
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH>7
C.温度不变,若在混合溶液中加入少量NaOH固体,则c(CH3COO-)减小
D.混合溶液中c(CH3COO-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢其水溶液适用于医用伤口消毒及环境消毒和食品消毒。
Ⅰ.过氧化氢性质实验
(1)酸性条件下H2O2可将水中的Fe2+转化成Fe3+,由此说明H2O2具有___________性。请写出该反应离子方程式: 。
(2)已知H2O2是一种二元弱酸,其中Ka1=1.0×10-12、Ka2=1.05×10-25;则H2O2的电离方程式为 ,常温下1mol·L-1的H2O2溶液的pH为 。
Ⅱ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO![]() +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
(3)滴定到达终点的现象是____________________。
(4)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为__________mol·L-1。
(5)若滴定前尖嘴中有气泡,滴定后消失,则测定结果________(“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4与氯气发生取代反应,待反应完全后,测定四种有机物的物质的量相等,则产生HCl的物质的量是
A.0.5mol B.2 mol C. 2.5 mol D.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com