
(18分)按要求回答下列问题
(1)某小组同学探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
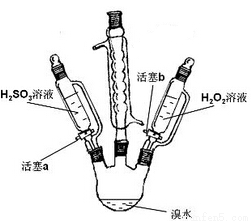
①打开活塞a,逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,该反应的离子方程式为________,得出的结论是:H2SO3的氧化性比Br2的氧化性______(填“强”或“弱”)。
②再打开活塞b,向所得溶液中逐滴加入H2O2,刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色,变橙黄色反应的离子方程式为_____________________________,得出的结论是H2O2的氧化性比Br2的氧化性____(填“强”或“弱”)。
(2)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,为了清楚沉淀的物质,研究小组向试管中加入过量稀盐酸,沉淀不溶解,你认为沉淀物是____________,产生该物质可能的原因是________________________。
(3)为探究SO2使品红溶液褪色的原因,该小组同学将干燥的SO2气体通入品红的四氯化碳溶液中,发现品红不褪色,由此所得出的结论正确的是__________(填编号)。
a.SO2使品红溶液褪色的微粒一定不是SO2分子
b.SO2使品红溶液褪色的微粒一定是H2SO3分子
c.此实验无法确定SO2使品红溶液褪色的微粒
d.将干燥的SO2气体通入品红的酒精溶液中,能使品红褪色由此可猜想使品红溶液褪色的微粒可能是___________________________。
(4)配平并完成下列离子方程式___MnO4-+___H2O2+___ ____=__Mn2++__O2+__H2O每有1mol高锰酸根参加反应,生成_______mol O2。
(18分,除标明分值外,其余每空均为2分。
(1)H2SO3+Br2+H2O=4H++SO42-+2Br-;弱(1分);2H++2Br-+H2O2=Br2+2H2O;强(1分)
(2)BaSO4(1分);空气中的O2将SO32-氧化为SO42-(只要体现出氧化均给分)
(3)a、c(少1个扣1分,错1个倒扣1分);H2SO3 或 HSO3- 或SO32-(3分,每种物质1分)
(4)_2_ MnO4-+_5_ H2O2+ _6_ _H+ = _2_ Mn2+ +_5_ O2 +_8_ H2O 2.5(1分)
【解析】
试题分析:(1)①逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,这说明溴被还原,因此该反应的离子方程式为H2SO3+Br2+H2O=4H++SO42-+2Br-;氧化还原反中氧化剂的氧化性强于氧化产物的氧化性,则H2SO3的氧化性比Br2的氧化性弱。
②溶液变为橙黄色,这说明溶液中的溴离子被氧化为溴,因此反应的离子方程式为2H++2Br-+H2O2=Br2+2H2O;氧化还原反中氧化剂的氧化性强于氧化产物的氧化性,则双氧水的樱花草强于溴的氧化性。
(2)沉淀不溶于盐酸,这说明沉淀一定是BaSO4;SO2溶于水与水反应生成亚硫酸,亚硫酸具有还原性,空气中的O2将溶液中的SO32-氧化为SO42-,从而产生硫酸钡沉淀。
(3)将干燥的SO2气体通入品红的四氯化碳溶液中,发现品红不褪色,这说明SO2使品红溶液褪色的微粒一定不是SO2分子。由于SO2溶于水溶液中仍然存在SO2分子,因此该实验也不能说明SO2使品红溶液褪色的微粒一定是H2SO3分子,ac正确,b错误;SO2通入酒精溶液中仍然是SO2分子,所以不能使品红褪色,d错误,答案选ac。
(4)反应中Mn元素的化合价从+7价降低到+2价得到2个电子。双氧水中氧元素的化合价从-1价升高到0价,失去1个电子,因此根据电子得失守恒可知氧化剂高锰酸钾和还原剂双氧水的物质的量之比是2:5。根据电荷守恒可知还有氢离子参加反应,则反应的离子方程式为2 MnO4-+5 H2O2+6H+=2 Mn2++5O2↑+8H2O。根据方程式可知每有1mol高锰酸根参加反应,生成2.5mol氧气。
考点:考查氧化还原反应的有关应用、SO2漂白原理探究


科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:填空题
(12分)O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为__________,原子个数比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为____ ,原子个数比为______,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是________ (用含NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
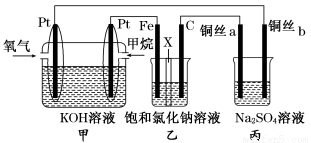
(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液。
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是: 。
(2)石墨电极(C)的电极反应式为______________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为___ L。
(4)铜丝a处在开始一段时间的现象为______________;原因是________________________________________________________________________。
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
a.电能全部转化为化学能
b.粗铜接电源正极, 发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为____________________________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.电解质溶液导电的过程实际上就是电解的过程
B.利用电解饱和食盐水所得的产物可以生产盐酸
C.化学反应的限度越大,则所有反应物的转化率就一定越大
D.氢氧燃料电池的负极通入的是氢气
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:选择题
A、B、C、D、E为短周期元素,其原子序数依次增大。其中A的最外层电子数为其周期数的2倍;B和D为同主族元素,其中B的氢化物在常温下为液态;C的+1价离子比E的-1价离子少8个电子。则下列说法正确的是
A.D氢化物的稳定性比B氢化物的稳定性强
B.5种元素中,E元素氧化物的水合物的酸性最强
C.A与B、D分别可形成AB2、AD2的化合物
D.B和C可形成离子化合物,且C离子的半径大于B离子的半径
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:选择题
在化学中有很多规律,下列对规律的应用正确的是
A.根据较强酸可制取较弱酸的规律,可向次氯酸钠溶液中通入二氧化碳制取次氯酸
B.根据金属与盐溶液混合发生置换反应的规律,可用钠置换出硫酸铜溶液中的铜
C.根据酸性氧化物不与酸反应的规律,可用二氧化硅制成的容器盛放氢氟酸
D.根据电荷守恒规律,可判断溶液中所含阳离子数目一定等于阴离子数目
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:实验题
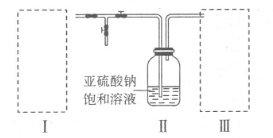
(12分)硫的化合物在工业上有广泛的应用,因此研究硫的化合物制备有着重要的意义。某同学拟采用下图装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5)。
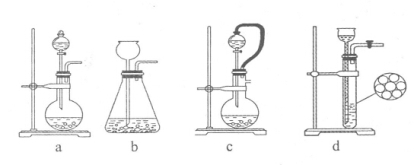
(1)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为 。如果想控制反应速度,下图中可选用的发生装置是 (填写字母)。
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是 ;某同学需要480 mL0.1mol/L焦亚硫酸钠溶液来研究其性质,配制时需称量焦亚硫酸钠的质量为 ;配制时除用到托盘天平、药匙、烧杯、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
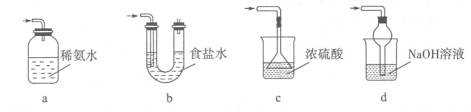
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:选择题
化学与生产、生活、环境密切相关。下列说法错误的是
A.航天飞机上的隔热陶瓷瓦属于复合材料
B.水泥、陶瓷均为硅酸盐产品
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D.化学反应能够制造出新的物质,同时也能制造出新的元素
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:选择题
下列说法不正确的是( )。
A.用加热法可除去Na2CO3中的NaHCO3
B.Na2CO3的热稳定性大于NaHCO3
C.可用石灰水区分Na2CO3与NaHCO3溶液
D.小苏打可中和胃酸、热纯碱可除去油污
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com