
【题目】不能正确表示下列变化的离子方程式是
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32—
+CO32—
D.醋酸钠水解:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.燃烧热和中和热的数值都会随反应物的用量不同而改变,故1molS(s)和2molS(s)的燃烧热不相等
B.已知:2C(s)+2O2(g)=2CO2(g) ΔH=akJ/mol,2C(s)+O2(g)=2CO(g)ΔH=bkJ/mol,则a>b
C.H2(g)的燃烧热为285.8kJ/mol,则表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l)ΔH=-571.6kJ/mol
D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ/mol,在低温条件下不能自发进行,但在高温条件下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种肼燃料电池的结构如图所示,下列说法正确的是( )
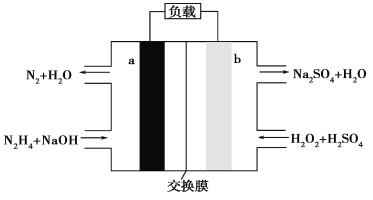
A. a极是正极,电极反应式为N2H4-4e-+4OH-=N2↑+4H2O
B. 电路中每转移NA个电子,就有1mol Na+穿过膜向正极移动
C. b极的电极反应式为H2O2+2e-=2OH-
D. 用该电池作电源电解饱和食盐水,当得到0.1mol Cl2时,至少要消耗0.1mol N2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:

已知:①有关A的信息如下:
能发生银镜反应 |
与FeCl3溶液发生显色反应 |
核磁共振氢谱显示有4组峰,峰面积之比为1∶2∶2∶1 |
②R1—CHO+R2—CH2—CHO![]()
![]()
回答以下问题:
(1)A中含有的含氧官能团名称是__________和_________。
(2)写出反应类型:G→H:_________,I→J:____________。
(3)写出下列过程化学方程式。
F→G_____________。B→C__________________。
(4)写出J的结构简式______________。
(5)结合题给信息,以D为原料经过三步反应制备1,3—丁二烯,设计合成路线(其他试剂任选)__________________________________________。
合成路线流程图示例:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
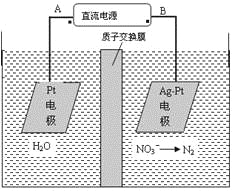
A.A为电源正极
B.阳极反应式为:2H2O-4e-=4H++O2↑
C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克
D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.强酸、强碱、重金属盐等可使蛋白质变性
B.用新制氢氧化铜悬浊液(必要时可加热)能鉴别甲酸、乙醇、乙醛
C.乙酸乙酯中混有的乙酸,可加入足量的饱和![]() 溶液,经分液除去
溶液,经分液除去
D.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是![]()
A.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关
B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5m的颗粒物,该值越高,代表空气污染程度越严重
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,食盐中所加含碘物质是KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种广泛使用的高分子材料助剂的结构简式,下列说法正确的是( )(CH3CH2CH2CH3可表示为![]()
![]()

A.该有机物的分子式为C24H40O4
B.1mol该有机物与氢气发生加成反应,最多消耗5mol氢气
C.该有机物在氢氧化钠作用下发生水解反应得到三种有机物
D.该有机物在FeBr3存在下与液溴发生取代反应生成两种一溴代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________。
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2=CH—CH2OH)的绿色高效合成,丙烯醇中碳原子的杂化类型有______________________;丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉。羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为______。
(4)Ni2+ 能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3的空间构型为_______;
(5)“NiO”晶胞如图:
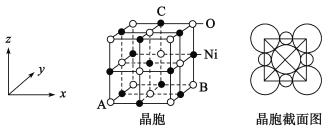
①氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为_____________;
②已知氧化镍晶胞密度dg/cm3,NA 代表阿伏加德罗常数的值,则Ni2+ 半径为________nm(用代数式表示)。(Ni的相对于原子质量是59)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com