
| A. | Fe2+、K+、SO42ˉ、NO3ˉ | B. | Mg2+、NH4+、SO42-、Clˉ | ||
| C. | Na+、K+、SO42ˉ、NO3ˉ | D. | Ba2+、Na+、CO32-、NO3ˉ |
分析 pH=0的溶液中含大量的氢离子,pH=14的溶液中含大量的氢氧根离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.Fe2+为浅绿色,与无色不符,故A不选;
B.碱溶液中不能大量存在Mg2+、NH4+,故B不选;
C.酸、碱溶液中该组离子之间均不反应,可大量共存,且离子均为无色,故C选;
D.酸溶液中不能大量存在CO32-,且CO32-、Ba2+结合生成沉淀,不能共存,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息、常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
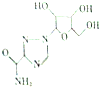 利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )| A. | 分子式为C8H12N4O3 | B. | 能使紫色石蕊试液变红 | ||
| C. | 可以发生酯化反应 | D. | 可以与H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的金属性、非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸和pH=11的氨水等体积混合 | |
| B. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液等体积混合 | |
| C. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片、铜片、稀硫酸 | B. | 铜片、石墨棒、硝酸银溶液 | ||
| C. | 锌片、铜片、稀硫酸 | D. | 铜片、银片、FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是第二周期元素 | B. | 一定是同一主族元素 | ||
| C. | 可能是第二、三周期元素 | D. | A、B只能形成化合物B2A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
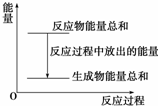 对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )| A. | Zn和H2SO4的总能量大于ZnSO4和H2的总能量 | |
| B. | 反应过程中能量关系可用如图表示 | |
| C. | 若将该反应设计成原电池,则Zn为负极 | |
| D. | 若将该反应设计成原电池,当有32.5g锌溶解时,正极放出11.2 L气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com