
分析 (1)加热条件下二氧化锰与浓盐酸反应生成氯化锰、氯气和水,据此书写离子方程式;
(2)4瓶氯气的质量为:0.1L×2.91g/L×4=1.164g,根据氯气和二氧化锰之间的关系式计算二氧化锰的质量;
(3)HCl被氧化生成氯气,根据氯元素守恒可知被氧化的n(HCl)=2n(Cl2).
解答 解:(1)用MnO2与浓盐酸反应制取氯气,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
答:制取氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)4瓶氯气的质量=0.1L×2.91g/L×4=1.164g,设需要二氧化锰的质量为x,
MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
87g 71g
x 1.164g
则87g:71g=x:1.164g
解得:x=$\frac{1.164g×87g}{71g}$=1.43g,
答:理论上需要MnO2固体的质量是1.43g;
(3)反应MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中HCl被氧化生成氯气,根据Cl元素守恒可知被氧化的HCl的物质的量为:n(HCl)=2n(Cl2)=$\frac{1.164g}{71g/mol}$×2≈0.033mol,
答:制取4瓶氯气,被氧化的HCl的物质的量是0.033mol.
点评 本题考查化学方程式的计算,题目难度不大,正确判断过量情况为解答关键,注意掌握守恒思想在化学计算中的应用,试题有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
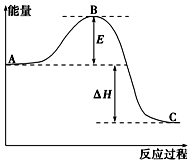 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据已学物质结构与性质的有关知识,回答下列问题:
根据已学物质结构与性质的有关知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 | |
| B. | 使用填埋法处理未经分类的生活垃圾 | |
| C. | 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 | |
| D. | 加速建设地铁、轻轨等轨道交通,促进武汉“8+1”城市圈-体化发展,减少汽车尾气排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点、沸点:Li>Na>K>Rb>Cs | B. | 密度:Li<Na<K<Rb<Cs | ||
| C. | 原子半径:Li>Na>K>Rb>Cs | D. | 还原性:Li>Na>K>Rb>Cs |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数和中子数均为6的碳原子${\;}_{6}^{6}$C | |
| B. | 溴化铵的电子式: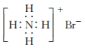 | |
| C. | 氢氧化钠的电子式: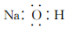 | |
| D. | 2-丙醇的结构简式: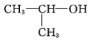 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取 | B. | 吸附 | C. | 结晶 | D. | 蒸发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com