
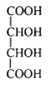
【题目】[物质结构与性质](1)酒石酸钛配合物广泛应用于药物合成。酒石酸(结构如图所示)中羧基氧原子的轨道杂化类型分别是______________
(2)氰酸(HOCN)的结构式是_________,根据等电子体原理,可推测氰酸根离子的空间构型是____。
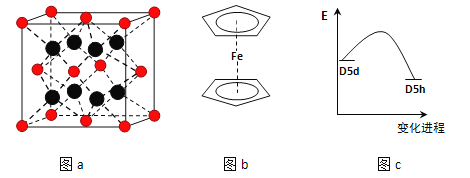
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为_____________.
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键.二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种.
①二茂铁的分子式为__________.
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷.因此每个环含有________个π电子.
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8~20kJ/mol.温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c.比较稳定的是__________结构(填“重叠”或“错位”).
(5)氧化镍(NiO)是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。基态Ni2+有_________个未成对电子,已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm列式表示其比表面积 ____________m2/g。
【答案】sp2H-O-C≡N直线型立方体C10H10Fe6重叠26000/Dρ
【解析】
(1)羧基的结构简式为![]() ,两个O原子的价层电子对数分别为3、4,则杂化类型分别为sp2、sp3;
,两个O原子的价层电子对数分别为3、4,则杂化类型分别为sp2、sp3;
(2)碳为四配位,氮为三配位,氧为两配位,故氰酸(HOCN)的结构式是N≡C-O-H;氰酸(HOCN)的结构式是N≡C-O-H,中心原子碳原子价层电子对个数=σ键个数+孤电子对个数=2+![]() (4-2×2)=2,采取sp杂化;CNO-电子数为22,与CNO-互为等电子体微粒为CO2,CO2是直线型分子,等电子体的结构相似,所以CNO-的空间构型是直线型;
(4-2×2)=2,采取sp杂化;CNO-电子数为22,与CNO-互为等电子体微粒为CO2,CO2是直线型分子,等电子体的结构相似,所以CNO-的空间构型是直线型;
(3)距一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体;
(4)①因为包含两个环戊二烯基与铁原子,又环戊二烯基为-C5H5,所以二茂铁的分子式为C10H10Fe;
②因为每个环戊二烯中含有5个C原子,在加上铁原子的一个电子,所以每个环含有的π电子数为6;
③由图象知,D5h的能量较低,所以比较稳定的是重叠结构;
(5)Ni的原子序数为28,电子排布式为1s22s22p63s23p63d84s2,基态Ni2+核外电子排布式为1s22s22p63s23p63d8,3d有8个电子,其中2个单电子;其纳米粒子的直径为Dnm=D×10-7m,表面积为4π(![]() ×10-7)2cm2=4π(
×10-7)2cm2=4π(![]() ×10-7)2×10-4 m2=4π(
×10-7)2×10-4 m2=4π(![]() ×10-7)2×10-4 m2=πD2×10-18m2,体积为
×10-7)2×10-4 m2=πD2×10-18m2,体积为![]() π(
π(![]() ×10-7)3cm3,纳米粒子的质量为
×10-7)3cm3,纳米粒子的质量为![]() π(
π(![]() ×10-7)3cm3×ρg/cm3=
×10-7)3cm3×ρg/cm3=![]() π(
π(![]() ×10-7)3×ρg=
×10-7)3×ρg=![]() g,比表面积为
g,比表面积为![]() =6000/Dρ。
=6000/Dρ。


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验探究元素周期律,如图所示。
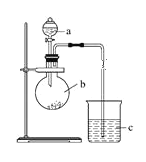
(1)仪器a的名称是____________,加入的药品为稀硝酸;仪器b的名称是____________,加入的药品为碳酸钠固体;b中反应现象为___________,验证氮的非金属性比碳的___(填“强”或“弱”)。
(2)c中装有硅酸钠溶液,c中反应现象为____,验证硅的非金属性比碳的___(填“强”或“弱”)。
(3)结论:同一周期从左到右元素非金属性逐渐____(填“增强”或“减弱”);同一主族从上到下元素非金属性逐渐_______(填“增强”或“减弱”)。
(4)某同学考虑到稀硝酸的挥发,则应在装置b和c之间增加一个盛有_______试剂的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的KW为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
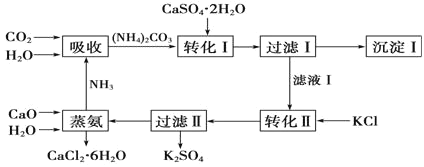
【题目】石膏转化为硫酸钾和CaCl2的工艺流程如图:
![]()
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是___(用化学方程式表示)。
(2)过滤Ⅰ得到的滤液是___,检验滤液中含有CO32-的方法__。
(3)转化Ⅱ中发生反应的化学方程式为___,转化Ⅱ中可获得K2SO4的原因是__。
(4)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是___。
a.熔点较低(29℃熔化) b.能制冷
c.无毒 d.能导电
(5)废水中氨氮(主要以NH4+和NH3形式存在)的去除常见的有生物脱氮法和电解法。而电解法产生的强氧化物质HClO也可将氨氮转化为氮气而除去,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性溶液来模拟。阳极的电极反应式___,处理1mol(NH4)2SO4,需要消耗HClO物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
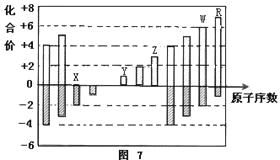
【题目】图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
 [
[
A. X的氢化物形成的晶体中存在的最强作用力是分子间作用力
B. R的气态氢化物溶于水,离子键断裂
C. W的气态氢化物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为0.1 molL-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
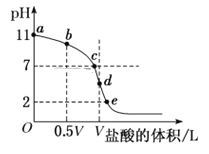
(1)该温度时NH3·H2O的电离常数K=________。
(2)滴定过程中所用盐酸的浓度________molL-1。
(3)比较b、c、d三点时的溶液中,水电离程度最大点为___________。(填字母)
(4)滴定时,由b点到c点的过程中,下列各选项中数值变大的是___(填字母,下同)。
A. c(H+)/c(OH-) B.c(H+)·c(NH3·H2O)/c(NH4+)
C.c(NH4+)·c(OH-)/c(NH3·H2O) D.c(H+)·c(OH-)
(5)根据以上滴定曲线判断下列说法正确的是______(溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(6)d点之后若继续加入盐酸至图像中的e点(不考虑NH4+水解的影响),则e点对应的横坐标为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
a(干燥气体) | b(液体) |
| |
A | NO | 水 | |
B | CO2 | 饱和NaHCO3溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1 mol·L-1盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电解池(MEC)制氢工作原理如右图所示。用该电解池电解0.1mol·L-1的CH3COOH溶液,下列说法正确的是
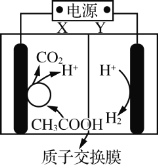
A.Y为电源的正极
B.该电解装置中,阳极的电极反应式为:CH3COOH+2H2O+8e-= 2CO2↑+8H+
C.当2mol H+通过质子交换膜时,则标准状况下产生22.4L H2
D.电解一段时间后,溶液中![]() 的值变小
的值变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com