
aXn-和bYm+是由短周期元素形成的简单离子,已知Xn-比Ym+多两个电子层,下列说法正确的是( )
A.X只能是第三周期元素 B.Y不可能是第二周期元素
C.b≤4 D.a-b+m+n等于10或20
科目:高中化学 来源: 题型:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的 pH 在 5.0~6.0 之间,通过电解生成 Fe(OH)3 沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成 浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示: (1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,则无法使悬浮物形成浮渣。
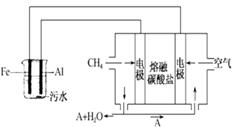

此时,应向污水中加入适量的_________。
a. H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是①______________;
②4OH--4e-=2H2O+O2↑
(3)电极反应①和②的生成物反应得到 Fe(OH)3 沉淀的离子方程式是__________。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以 CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是 CH4+4CO2-8e-===5CO2+2H2O。
①正极的电极反应是______________。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。 则 A 物质的化学式是___________。
(5)实验过程中,若在阴极产生了 44.8L(标准状况)气体,则熔融盐燃料电池消耗 CH4_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.氨气分子是极性分子而甲烷是非极性分子。
D.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
查看答案和解析>>
科目:高中化学 来源: 题型:
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是
A. K3C60中既有离子键又有极性键 B.1mol K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电 D.该物质的化学式可写作KC20
查看答案和解析>>
科目:高中化学 来源: 题型:
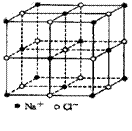
食盐晶体如图所示。在晶体中,· 表示Na+,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
 |
A. 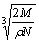 cm B.
cm B. 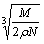 cm
cm
C. 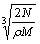 cm D.
cm D. 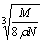 cm
cm
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
 |
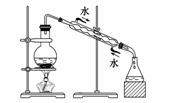
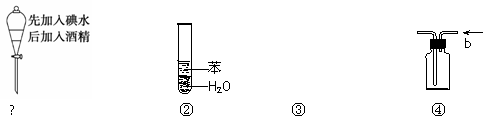 |
A.溶液上层无色,下层紫红色
B.装置②可用于吸收HCl气体,并防止倒吸
 C.装置③可用于制取蒸馏水
C.装置③可用于制取蒸馏水
D.装置④ b口进气可收集H2、CO2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
 |
提供的试剂:
饱和Na2CO3溶液、 饱和K2CO3溶液 、NaOH溶液 、BaCl2溶液、Ba(NO3)2溶液
(1)欲除去溶液I中的Ca2+、Mg2+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为 _______________________________________(只填化学式)。
(2)操作Ⅲ的名称是_________,所需用到的仪器主要有铁架台、酒精灯、铁圈、______________________ (填仪器名称)。
(3)加盐酸的目的是(用离子方程式表示) 、 。
Ⅱ.一份无色溶液中可能含有Na+ 、Fe3+、H+ 、Mg2+、CO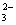 、OH-、HCO
、OH-、HCO 、Cl-、SO42-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-、SO42-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
① 向溶液中滴加酚酞试液,溶液显红色;
② 取2 mL溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(4)原溶液中一定存在的离子是 , 一定不存在的离子是 。
(5)经过上述操作后,还不能肯定是否存在的离子是 。对可能含有的离子,如何进行实验以进一步检验。 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是
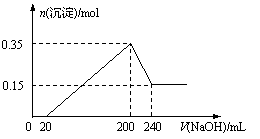
A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol/L
C.NaOH溶液的物质的量浓度为5 mol/L
D.生成的H2在标准状况下的体积为11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com