
 在常温下,某水溶液M中.
在常温下,某水溶液M中.分析 (1)含有Na+、CH3COO-、H+、OH-,的溶液可能为醋酸钠溶液、可能为醋酸钠和醋酸的混合液、可能为醋酸钠和氢氧化钠的混合液;
(2)M由两种相同物质的量浓度的溶液混合而成,其中只存在OH-、H+、NH4+、Cl-四种离子,溶液可能为氯化铵和氨水或氯化铵和盐酸,c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液为碱性,以此来分析;
(3)溶质为氯化铵,由电荷守恒来分析;
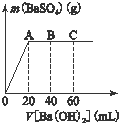
(4)①据Ba(OH)2+H2SO4═BaSO4↓+2H2O计算硫酸的物质的量浓度,再利用H++OH-═H2O来计算盐酸的物质的量浓度;
②B点是反应滴入氢氧化钡溶液40ml,依据原溶液中氢离子知道了和滴入氢氧根离子物质的量计算得到剩余氢离子物质的量计算氢离子浓度,得到溶液PH.
解答 解:(1)①若溶液的溶质质量醋酸钠,由醋酸根离子水解显碱性可知,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故①正确;
②若溶液为醋酸钠和NaOH的混合物,溶液显碱性,且NaOH的物质的量远大于醋酸钠的物质的量时存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故②正确;
③若存在c(H+)>c(OH-)>c(Na+)>c(CH3COO-),不遵循电荷守恒,故③错误;
④若为醋酸钠和醋酸的混合液,溶液为中性,则c(Na+)=c(CH3COO-)且c(OH-)=c(H+),故④正确;
故答案为:①②④;
(2)M由两种相同物质的量浓度的溶液混合而成,其中只存在OH-、H+、NH4+、Cl-四种离子,溶液可能为氯化铵和氨水或氯化铵和盐酸,c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液NH4Cl和NH3(或NH4Cl和NH3•H2O),故答案为:NH4Cl和NH3(或NH4Cl和NH3•H2O);
(3)M为0.01mol/L的氨水,向其中加入等体积pH=2的盐酸溶液生成0.005mol/LNH4Cl溶液,则由电荷守恒可知c(NH4+)+c(H+)-c(OH-)=c(Cl-)=0.005mol/L,
故答案为:0.005mol/L;
(4)①由Ba(OH)2+H2SO4═BaSO4↓+2H2O,
1 1 1
x 0.001mol
则c(H2SO4)=$\frac{0.001mol}{0.02L}$=0.05 mol/L,
加入60mL Ba(OH)2溶液时,溶液的pH=7,设盐酸的浓度为y,则
0.06L×0.05mol/L×2=0.02L×0.05 mol/L×2+0.02L×y,
解得y=0.2mol/L,即c(HCl)=0.20 mol/L,
故答案为:0.05mol/L;0.20mol/L.
②B点滴入氢氧化钡溶液体积为40ml,
依据H++OH-=H2O计算
n(OH-)=0.05mol/L×0.04L×2=0.004mol
n(H+)=0.05mol/L×2×0.02L+0.20mol/L×0.02L=0.006mol
B点溶液中c(H+)=$\frac{0.006mol-0.004mol}{(0.02+0.04)L}$=$\frac{0.1}{3}$mol/L,
pH=-lg$\frac{0.1}{3}$=1.48,
故答案为:1.48.
点评 本题考查离子浓度大小的比较、水解、电离及有关化学反应方程式的计算,综合性较强,难度较大,注重对常考考点的考查.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{12}^{24}$Mg和${\;}_{12}^{26}$Mg互为同位素 | B. | 氯原子的结构示意图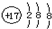 | ||
| C. | 氯化钠的电子式是 | D. | 乙酸与乙醇互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将12.00g胆矾配成500mL溶液 | |
| B. | 将12.50g胆矾溶于少量水中,再用水稀释至500mL | |
| C. | 称取7.68g硫酸铜,加入500mL水 | |
| D. | 在80mL0.6mol/L CuSO4溶液中加入400mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. | 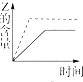 | D. | 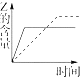 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
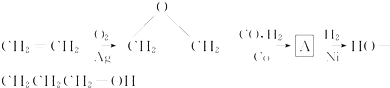
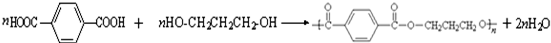 .
.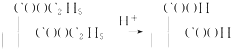 ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.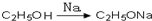 、
、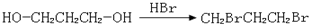 、
、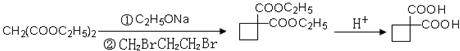 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.| 温度(℃) | 800 | 1000 | 1200 | 1400 |
| 平衡常数(K) | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3 | B. | 稀硫酸 | C. | AgNO3溶液 | D. | CuSO4 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com