
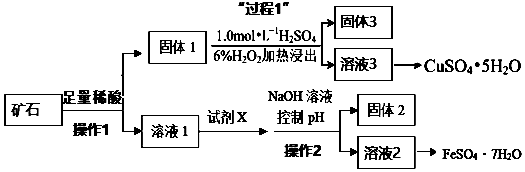
分析 矿石(成分为40%Fe2O3、48%CuS、5%SiO2、7%Al2O3) 为原料制取绿矾和胆矾流程:矿石加入足量稀硫酸,发生的反应有Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O,CuS不溶于非氧化性酸,SiO2不溶于稀硫酸,固体1为CuS、SiO2,滤液溶液1中含有Fe2(SO4)3、Al2(SO4)3;在滤液1中加入X,然后加入NaOH溶液并调节溶液的pH,得到沉淀Al(OH)3 和溶液2,从溶液2中能得到FeSO4•7H2O晶体,说明溶液2中溶质为FeSO4,则X具有还原性,能将Fe3+氧化为Fe2+,且不能引进新的杂质,则X为Fe,加入试剂X发生的离子反应有2 Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,将溶液2蒸发浓缩、冷却结晶、过滤得到FeSO4•7H2O晶体,固体1为CuS、SiO2,加1mol/L的H2SO4he和6%H2O2,SiO2不溶于稀硫酸,然后过滤,得到的固体3成分为SiO2,将溶液3蒸发浓缩、冷却结晶、过滤得到CuSO4•5H2O晶体.
(1)CuS不溶于非氧化性酸,SiO2不溶于稀硫酸,固体1为CuS、SiO2,X具有还原性,能将Fe3+氧化为Fe2+,且不能引进新的杂质,则X为Fe;
(2)在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,若碱性太强,会导致产品中混有较多可溶性杂质偏铝酸钠;
(3)将溶液2蒸发浓缩、冷却结晶、过滤得到FeSO4•7H2O晶体,可以直接加热的硅酸盐仪器为蒸发皿;
(4)硫酸亚铁结晶水合物晶体受热分解生成氧化铁、二氧化硫、三氧化硫和水,结合原子守恒配平书写化学方程式;
(5)“固体3”中含有淡黄色固体为S,CuS被氧化成硫,结合原子守恒配平书写离子方程式;
(6)根据硫元素守恒计算出理论产量,根据回收率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)矿石(成分为40%Fe2O3、48%CuS、5%SiO2、7%Al2O3) 为原料制取绿矾和胆矾流程:矿石加入足量稀硫酸,发生的反应有Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O,CuS不溶于非氧化性酸,SiO2不溶于稀硫酸,固体1为CuS、SiO2,滤液溶液1中含有Fe2(SO4)3、Al2(SO4)3;在滤液1中加入X,然后加入NaOH溶液并调节溶液的pH,得到沉淀Al(OH)3 和溶液2,从溶液2中能得到FeSO4•7H2O晶体,说明溶液2中溶质为FeSO4,则X具有还原性,能将Fe3+氧化为Fe2+,且不能引进新的杂质,则X为Fe,
故答案为:CuS、SiO2;Fe;
(2)氢氧化铝为两性氢氧化物,在滤液1中加入铁,然后加入NaOH溶液并调节溶液的pH,得到沉淀Al(OH)3 和溶液2,若碱性太强,会导致氢氧化铝溶解,氢氧化铝和氢氧化钠溶液的反应生成偏铝酸钠和水,离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)从溶液中获取晶体的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,该操作需蒸发皿、酒精灯、玻璃棒等仪器,可以直接加热的硅酸盐仪器为蒸发皿,
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;蒸发皿;
(4)FeSO4•7H2O在高温下分解,生成四种氧化物,其中之一为红棕色固体为Fe2O3,另外还有两种含硫的氧化物为SO2、SO3,反应物为硫酸亚铁结晶水合物晶体受热分解生成氧化铁、二氧化硫、三氧化硫和水,结合原子守恒配平书写化学方程式为:2FeSO4•7H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3+14H2O,
故答案为:2FeSO4•7H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3+14H2O;
(5)“固体3”中含有淡黄色固体为S,CuS被氧化成硫,反应的离子方程式为:CuS+H2O2+2H+=Cu2++S↓+2H2O,
故答案为:CuS+H2O2+2H+=Cu2++S↓+2H2O;
(6)10kg某矿石成分含48%CuS,CuS的物质的量为n=$\frac{m}{M}$=$\frac{10×1{0}^{3}g×48%}{96g/mol}$=50mol,理论得到m(CuSO4•5H2O)=nM=50mol×250g/mol=12500g,在实验完成之后,得到10kg CuSO4•5H2O,则铜元素的回收率=$\frac{实际产量}{理论产量}$×100%=$\frac{10kg}{12.5kg}$×100%=80%,
故答案为:80%.
点评 本题考查物质分离和提纯,为高频考点,侧重考查制备实验方案的设计与评价、工艺流程的分析应用、分析推断及基本操作能力,明确物质性质及流程图中可能发生的反应、基本操作方法是解本题关键,注意把握常见物质的分离方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
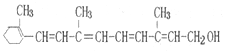
| A. | 维生素A分子式为C18H24O | |
| B. | 维生素A不能使溴的四氯化碳溶液褪色 | |
| C. | 维生素A不能与金属钠反应产生氢气 | |
| D. | 维生素A能发生氧化、加成、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu | B. | F | C. | H | D. | Mn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCO3、MgO、Mg2N3 | B. | MgCO3、MgO、Mg(OH)2 | C. | MgO、Mg2N3、C | D. | MgCO3、C、Mg2N3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阳极上发生的都是氧化反应 | |
| B. | 实验室用惰性电极电解NaCl溶液,阴、阳两极收集到的气体体积之比为1:1 | |
| C. | 一定条件下可能发生反应:Cu+H2SO4═CuSO4+H2↑ | |
| D. | 在用惰性电极电解稀硫酸的过程中,溶液pH保持不变. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g | B. | 50g | C. | 72g | D. | 80g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
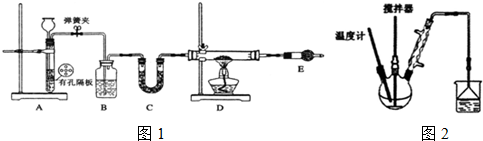
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
| 相对式量 | 112.5 | 147 | 162.5 | 128 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com