
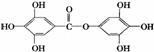
已知A物质的分子结构简式如下,lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为 ( )
A、6mol B、7mol
C、8mo1 D、9mo1
科目:高中化学 来源: 题型:
(1)下列实验操作或对实验事实的描述不正确的是 (填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1NaOH溶液450 moL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是 (填序号);配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
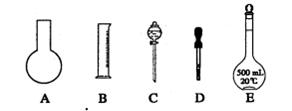
②下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
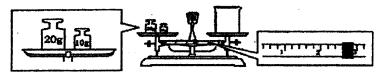
③请计算需用托盘天平称取固体NaOH的质量为 g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,烧杯的实际质量为 g。
④根据计算得知,所需质量分数为98%、密度为I.84 g·cm-3的浓硫酸的体积为 mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
【答案】(1)D (2)①A C; 烧杯、玻璃棒 ②B C E ③ 2.0;27.4
④13.6; 将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌。
查看答案和解析>>
科目:高中化学 来源: 题型:
在氨的催化氧化中有副反应发生:4NH3 +3O2=2N2+6H2O.已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1= -907KJ/mol,N2(g)+O2(g)=2NO(g)△H2= +180.5KJ/mol.则反应4NH3 (g)+3O2(g)=2N2(g)+6H2O(g)的△H为( )
A.-726.5 KJ/mol B.-1087.5KJ/mol
C.-1268 KJ/mol D.+1994.5 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
由2-氯丙烷制取少量1,2-丙二醇时,需要经过下列哪几步反应: ( )
A、加成→消去→取代 B、消去→加成→取代
C、取代→消去→加成 D、消去→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
从柑橘中炼制萜二烯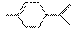 ,下列有关它的推测,不正确的是 ( )
,下列有关它的推测,不正确的是 ( )
A、它不能使酸性高锰酸钾溶液褪色
B、常温下为液态,难溶于水
C、分子式为C10H16
D、与过量的溴的CCl4溶液反应后产物如右图

查看答案和解析>>
科目:高中化学 来源: 题型:
有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯 ②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色 ④乙烯使酸性高锰酸钾溶液褪色 ⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应 ⑦溴乙烷和氢氧化钠乙醇溶液共热⑧溴乙烷和氢氧化钠溶液共热
其中属于取代反应的是 ;属于氧化反应的是.________;属于加成反应的是.________;属消去反应的是 ;属于聚合反应的是_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
同周期主族元素,随原子序数递增,下列说法中错误的是( )
A.最外层电子数逐渐增多 B.原子半径逐渐减小
C.元素最高正化合价由+1递增到+7 D.金属性逐渐减弱,非金属性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)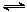 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)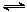 CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)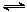 CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)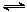 CH3OCH3(g)+CO2(g)的△H= ▲ kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= ▲ kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 ▲ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 ▲ 。
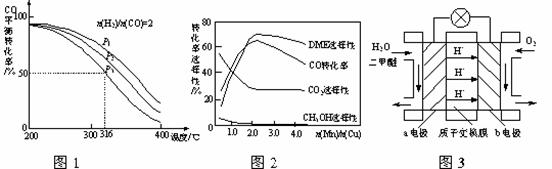
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 ▲ 。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 ▲ 。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 ▲ 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 ▲ 。
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com