
一块表面已被氧化为氧化钠的钠块5.4g,投入50g水中,最多能产生0.10g气体,则原来被氧化的钠是( )
| A.2.3g | B.3.1g | C.4.6g | D.5.3g |
A
解析试题分析:根据钠和水反应生成氢氧化钠与氢气的化学方程式,找到题给的已知量氢气的质量,求得参加反应的钠的质量,再计算出被氧化的钠的质量。
设产生0.10g氢气需钠的质量为x
2Na+2H2O=2NaOH+H2↑
46g 2g
x 0.1g
解得x=2.3g
则氧化钠的质量是5.4g-2.3g=3.1g
则对应的被氧化的钠的质量为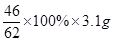 =2.3g
=2.3g
答案选A。
考点:考查关键方程式以及钠被氧化的有关计算
点评:该题是中等难度的试题,侧重对学生答题能力的培养,有利于培养学生的规范答题能力。根据化学方程式计算时,反应物和生成物的质量关系都是纯量,注意解题格式要规范完整,另外本题还要注意审题,被氧化的钠和氧化钠是两码事,不能混淆。


科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
| B.1molNa2CO3晶体中含CO32ˉ离子数小于NA |
| C.惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体11.2L |
| D.0.1mol的CaO2中含阴离子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.1mol Cl2溶于足量水中转移电子数为NA |
| B.在熔融状态下,1molKHSO4完全电离出的阳离子数为2NA |
| C.标准状况下,22.4LNO与CO2的混合气体中含有的原子数为2NA |
| D.CaC2含有的π键的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学用语正确的是 ( )
| A.1,2—二溴乙烷的结构简式:C2 H4 Br2 |
| B.羟基的化学式:OH- |
| C.己烷的分子式:C6H12 |
| D.乙烯分子的最简式:CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组物质中分子数相同的是( )
| A.2LCO和2LCO2 |
| B.9gH2O和标准状况下11.2LCO2 |
| C.标准状况下1molO2和22.4LH2O |
| D.0.2molH2和4.48LHCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| B.0.5molC3H8分子中所含C-H共价键数为2NA |
| C.标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA |
| D.1mol碳正离子CH5+所含的电子数为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)按要求回答问题:
Ⅰ(1)硫酸酸化的高锰酸钾溶液与草酸反应离子方程式
(2)硫代硫酸钠与硫酸反应的化学方程式
Ⅱ工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为?890.3kJ?mol?1、?285. 8 kJ?mol?1和?283.0 kJ?mol?1,则生成1m3(标准状况)CO所需热量为
kJ
Ⅲ 请写出下列物质电子式
CO2 H2O2 NH4Cl N2H4
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温 度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com